 Реферат: Сравнительная характеристика методов лабораторной диагностики трихомоноза
Реферат: Сравнительная характеристика методов лабораторной диагностики трихомоноза
Подтверждением того, что указанные выше клетки являются трихомонадами атипичной (амебовидной), формы, служат следующие факты:
1. Их находят одновременно с типичными паразитами, а также у тех больных, у которых подвижность трихомонад отсутствует, но которые являлись источником заражения трихомонозом нескольких человек.
2. Они исчезают после противотрихомонадного лечения и появляются вновь лишь при рецидивах и реинфекциях.
3. Метронидазол (трихопол) эффективен при лечении больных, у которых в абактериальном отделяемом обнаружены такие клетки.
4. При хроническом уретрите и рецидивах типичные трихомонады появляются у больных, у которых в острой стадии обнаруживаются только эти клетки.
5. Они отсутствуют у больных с другими формами уретритов, если нет смешанной инфекции.
6. Типичные трихомонады обнаруживают у большинства половых партнерш лиц, которым диагноз трихомоноза был установлен на основании обнаружения этих клеток.
7. При посеве материала от больных, у которых выявлены такие клетки, нередко вырастают типичные трихомонады.
Представляет интерес то обстоятельство, что типичные подвижные трихомонады чаще выявляют при хроническом и торпидном уретрите, нередко осложненном хроническим простатитом, тогда как при острых уретритах обнаруживают мало паразитов - в основном атипичные амебоидные формы[7,10,14,15,19].
1.4.2 Культуральное исследование
Служит важным звеном лабораторной диагностики трихомоноза у мужчин и женщин, особенно при распознавании атипичных форм паразитов и выявлении их у лиц, получавших противотрихомонадные препараты при трихомонадоносительстве. Разумеется, посевы необходимо проводить параллельно микроскопии нативных и окрашенных препаратов и повторять при отрицательных результатах.
Разноречивая оценка культурального метода диагностики трихомоноза связана, в первую очередь, с использованием нестандартных питательных сред, нередко обладающих низкими качествами. Достаточной чувствительностью обладает среда СКДС, разработанная В. Н. Бедновой. Среди импортных высоким качеством обладают также среды «Diamon», «Kupferberg», «Asani», а также тест – система «Трихомоно-Скрин» Дмитриева .
Метод выращивания трихомонад в бульонной культуре - "золотой стандарт" для диагностики, потому что это простой в интерпретации метод и требует менее чем 300-500 трихомонад/мл инокулюма для начала роста в культуре. Тем не менее, для него существуют ограничения, присущие культуральным методам. Для диагностики необходим инкубационный период от 5 до 7 дней, являющийся слишком длительным из-за возможности инфицированного пациента к распространению инфекцию. В связи с этим он не получил широкого применения в клинической практике в качестве прямого диагностического метода.
Для улучшения восприятия культурального метода, за рубежом был разработан метод пластикового конверта, с помощью которого можно выполнить как немедленную проверку присутствия трихомонады, так и сохранить дальнейший рост трихомонад в одной самоподдерживающейся системе. Полученные результаты сравнимы с таковыми при исследовании мазка и культур. Аналогично пластиковому конверту используется система «InPouch» в виде двухкамерного мешка, позволяющая выполнить быструю проверку культуры путём микроскопии через стенку мешка.
Технология роста патогена на клеточной культуре использует свойства клеточных линий восстанавливать рост T.vaginalis из клинических образцов. Было продемонстрировано, что этот метод даёт лучшие результаты - относительно культивирования в бульоне и приготовления влажной камеры, поскольку способен определять T.vaginalis в концентрациях менее 3 организмов в 1 мл. Однако культивирование в культуре - это не простой рутинный метод; он дорог и неудобен для быстрой диагностики[5,9, 14,15,22,29,36,37]
1.4.3 Иммунологические методы
Ограничения культуральных и микроскопических методов для выявления T.vaginalis заставили учёных развивать альтернативные методы, которые могут определять антиген, антитело или нуклеиновые кислоты в уретральном или вагинальном экссудате. Иммунологические методы не получили должного распространения из-за отсутствия качественных отечественных тест-систем. Кроме этого, все методы серологической диагностики T.vaginalis мало информативны, т. к данный антиген не вызывает 100%-го иммунного ответа. Хотя для подтверждения диагноза ими можно воспользоваться. Используются различные методы определения антител: агглютинация, непрямая гемаглютинация, диффузия в геле, флюоресценция антител и иммуноферментный анализ, метод иммуноблотинга. Определённое диагностичическое значение имеет прямое определение специфических белков T.vaginalis в биопробах с использованием моноклональных антител в качестве быстрого метода диагностики трихомоноза. Прямой иммуноферментный и иммунофлюоресцентный анализ мазков вагинального соскоба (тест-система фирмы California Integrated Diagnostics, Benicia, Calif.), использующий перокидазо - и флюорохром - меченые смеси моноклональных антител к различным структурам T.vaginalis был таким же чувствительным и специфичным, как и используемый культуральный метод. К тому же результаты определения возбудителя трихомоноза получают в течение одного часа, что позволяет произвести экспресс-скрининг [10,17,35,41,42].
1.4.4 Методы генной диагностики T.vaginalis
С начала 90-х годов в лабораторную клиническую практику стали, внедрятся технологии определения видоспецифических нуклеотидных последовательностей областей ДНК (мишеней) бактерий и клеток высших организмов. Сначала это была ДНК-гибридизационная технология. В тест-системе Affirm VP используются синтетические зонды для выявления как Gardnerella vaginalis, так и T.vaginalis из одного вагинального соскоба. Данная методика лучше, чем метод влажной камеры. Тем не менее, встречались ложноотрицательные результаты при её сравнении с культуральным методом (80% чувствительности относительно положительных образцов в культуре). Одна из гибридизационных методик - “дот-блот” гибридизация, в которой использовался фрагмент 2,3 ДНК T.vaginalis в качестве зонда, могла определить ДНК T.vaginalis в вагинальном секрете. Однако нестабильность зонда, выполнение специфических технических приёмов, особенно использование радиоактивной метки, являлись большими недостатками этой методики. После того как радиоактивно меченный зонд заменили на флюоресцентно-меченный ДНК-зонд, эта методика сразу нашла своё применение при выявлении бессимптомного носительства T. vaginalis. Новая генодиагностическая технология - ПЦР, в последнее время опережает остальные методы генодиагностики трихомоноза и наравне с культуральным методом широко используется в клинической практике. Риу в 1999 г. предложили ПЦР методику идентификации ДНК влагалищной трихомонады с праймерами для амплификации повторяющегося фрагмента TV-E650. Сравнив свой метод с другими используемыми методиками диагностики: микроскопией нативного мазка, культуральным, а также с клиническими данными. Он считает, что предложенный метод ПЦР на 100% чувствителен и специфичен, т.к. не давал перекрёстной реакции с другими простейшими и Candida albicans. Использованная им методика ПЦР в два раза чаще выявляла трихомонаду, чем другие лабораторные методики. Японские учённые так же сумели подтвердить правомерность постановки диагноза “трихомониаз” в 19-ти случаях у женщин и в одном случае у мужчины методом ПЦР[43,44,45,46,48].
1.5. Лечение трихомоноза
Препарат выбора - метронидазол, или его аналог. Препарат назначают внутрь, внутривенно или внутривагинально. Эффективность химиотерапии достигает 80-95%. В последнее время чаще рекомендуется применять комплексную терапию, с использованием новейших препаратов, к примеру, таких, как Наксоджин. Кроме этого советуют проводить местную обработку слабыми дезинфекторами и растворами, снимающими воспаление. Причина данной терапии обусловлена адаптационными механизмами трихомонад. В силу чего сегодня редкий врач владеет методикой эффективного лечения этой патологии [1,2,18,25].
2.МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Все исследования по теме квалификационной работы проводились на базе Одесского областного кожно-венерологического диспансера, расположенного по адресу: г. Одесса, ул. Воробьева, 5.
В исследовании, которое проходило в период с декабря 2003 года по май 2004 года, принимали участие исключительно мужчины в количестве 150 человек. Пациенты были обследованы на трихомоноз тремя методами: культуральным, микроскопии окрашенного мазка и ПЦР.
Всем обследуемым, за сутки до взятия материала производилась внутримышечная инъекция пирогенала, в дозе – 50 МПД, согласно инструкции приведенной [18]. Вследствие чего на момент анализа у 60% больных отмечались слизистые, слизисто – гнойные выделения.
2.1. Исследование культуральным методом.
Культуральный метод исследования заключался в посевах патологического материала (отделяемого уретры) на ИПС, по методике [21]. Использовалась питательная среда для выделения влагалищных трихомонад (Э).
Следующего состава, г/л:
ферментолизат биомассы микроорганизмов без оболочек
(осветлённый) 14,2
мальтоза 8,0
хлорид натрия 6,0
хлорид калия 0,1
карбонат натрия 1,2
РН среды доводился до 6,0 ± 0,2.
Препарат разработан ЦКВИ, выпускается НПО “ Питательные среды“.
Материал выделений и соскоб забираются ложечкой Фолькмана, если выделения обильные, то можно использовать бактериологическую петлю, при этом для увеличения отделяемого, левой рукой производится массаж уретры выжимающими приёмами (дистально-проксимальное направление). При посеве ложечка Фолькмана с посевным материалом опускается в среду до дна пробирки и энергично круговыми движениями смывается. Пробирка у спиртовки закрывается ватно-марлевой пробкой и ставится на инкубацию при 37 градусах Цельсия.
Учёт результатов проводился путём микроскопического исследования препаратов через 7 дней после посева. Осадок отбирался пастеровской пипеткой и микроскопировался в тёмном поле с увеличением 280. При положительном результате наблюдались движущиеся паразиты: одиночные или в скоплениях. Все препараты смотрелись нативными.
2.2. Исследование методом микроскопии мазка.
Метод микроскопии мазка основан на анализе соскоба или выделений, с последующей их окраской, методика[39]. Соскоб берется желобоватым зондом или тупой ложечкой из уретры. Из ложечки биологический материал извлекался копьём для перфорации кожного покрова. Выделения брались мазком – отпечатком.
Стекла обрабатывались так же, как и посуда, бывшая в употреблении, мылись и кипятились 15 минут в 0,5% мыльном растворе, затем многократно ополаскивались в горячей воде и не менее 5 раз в дистиллированной. После этого сушились в сухожаровом шкафу. Далее натирались между двумя дощечками с прикреплённой тканью и помещались до опыта в смесь спирта с эфиром 1:1. (Чистота стёкол в подобной диагностике имеет важное значение!)
Отобранный материал эмульгировался (очень нежно) на предметном стекле, после чего высушивался на воздухе 20-30 минут, затем окрашивался – 1% раствором метиленового синего, в течении 3 минут. В положительных случаях, обнаруживались трихомонады различной формы. Не больше одной в поле зрения.
Ядро окрашивалось в темно – синий, а протоплазма – в бледно-синий цвет. Трихомонады имели: овальную, круглую и грушевидную формы. Препарат смотрелся при увеличении 630 с иммерсионным объективом.
2.3 Исследование методом ПЦР
Для ПЦР – диагностики использовались соскобы уретры.
Все анализы на основе этого метода по группам больных проводились сотрудниками кафедры Кожных и венерических болезней Одесского Государственного Медицинского Университета.
Результаты обследованных были любезно предоставлены {XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX}! Простите этого человека не указываю!
3.РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
В ходе проведения собственных исследований по сравнению различных методов диагностики трихомоноза у мужчин, общее количество которых составляло 150 человек, были получены следующие результаты: наиболее удачным методом диагностики трихомоноза является метод микроскопии окрашенного мазка. Его информативность составила 71%. За ним следует метод ПЦР, (включающий в себя данные исследований по различным группам), он составил 26%. И наименее информативным, а, следовательно, менее надежным методом диагностики трихомоноза, оказался культуральный метод. Его информативность составила 3%. Полученные результаты отражены на рисунке 1.
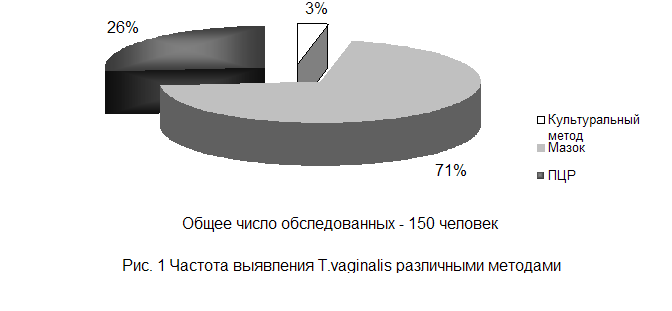
Исходя из результатов исследований можно сделать следующие выводы: для экспресс – диагностики мочеполового трихомоноза наиболее удобно использовать метод микроскопии окрашенного препарата уретрального соскоба или окрашенного мазка выделений. Более надёжный результат будет при проведении предварительной провокации пирогеналом. В случае непереносимости препарата (больные с острыми лихорадочными заболеваниями, беременные, гипертоники, диабетики), его можно заменить определенной комбинацией продуктов раздражающих слизистую оболочку желудка.
Данный метод имеет, перед остальными способами диагностики, ряд преимуществ: относительно недорогой и простой в проведении, результат достигается по истечении короткого промежутка времени, не требует применения дорогого лабораторного оборудования и высокой квалификации персонала.
В отношении метода ПЦР – диагностики трихомоноза, можно отметить следующее: по своей информативности он сегодня ещё уступает методу микроскопии окрашенного мазка. Это обусловлено недостаточной степенью очистки ДНК – возбудителя от балластных компонентов биоптата. Весомым недостатком ПЦР метода являются, сложность постановки опыта, необходимость применения дорогого оборудования и высокая стоимость анализа.
В настоящее время метод ПЦР диагностики T.vaginalis ещё недостаточно отработан. Такой вывод можно сделать на основании данных предоставленных сотрудниками кафедры Кожных и венерических болезней ОГМУ.
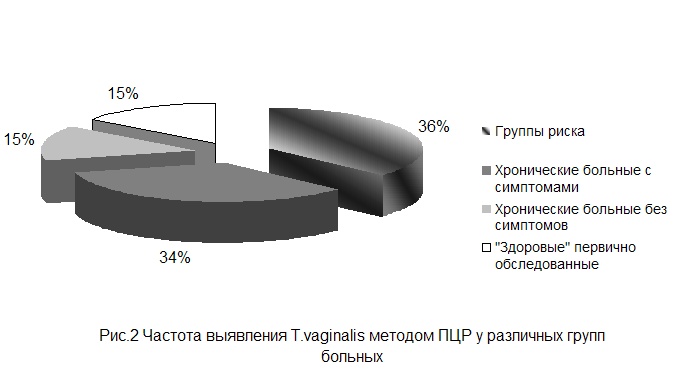 Метод ПЦР подтвердил наличие трихомонад у больных отнесённых
к группе риска на 36%. У хронических больных с характерными симптомами этот
показатель составил 34%, хронические больные без симптоматики и «здоровые»
первично обследуемые, дали по-15% подтверждения. Данная информация отражена на
рисунке 2.
Метод ПЦР подтвердил наличие трихомонад у больных отнесённых
к группе риска на 36%. У хронических больных с характерными симптомами этот
показатель составил 34%, хронические больные без симптоматики и «здоровые»
первично обследуемые, дали по-15% подтверждения. Данная информация отражена на
рисунке 2.
Культуральный метод оказался наименее информативным при проведении исследований, на его долю приходится всего 3% выявления трихомонад. В сравнении с методиками, приведёнными раннее, он является самым длительным и наименее надёжным для диагностики трихомоноза.
3.1 Анализ данных выявления T.vaginalis у жителей Одесского региона
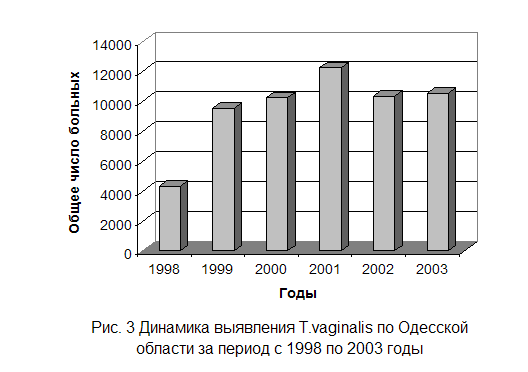 Информация, представленная на рисунках 3 и 4, была получена в
результате анализа данных отдела медицинской статистики. Она отражает динамику
случаев первичного выделения возбудителя трихомоноза у мужчин и женщин в период
1998 – 2003 годы. База данных по заболеваниям за 2004 год находится на стадии
обработки.
Информация, представленная на рисунках 3 и 4, была получена в
результате анализа данных отдела медицинской статистики. Она отражает динамику
случаев первичного выделения возбудителя трихомоноза у мужчин и женщин в период
1998 – 2003 годы. База данных по заболеваниям за 2004 год находится на стадии
обработки.
.
Согласно полученным данным по Одесской области можно сделать заключение, что резкое увеличение заболеваемости произошло в период с 1998 по 1999 годы. За период с 1999 по 2000 год прирост заболеваемости был незначительным. Пиковый показатель имеет количество заболевших в 2001 году, по сравнению с 2000 годом, число больных выросло на две тысячи человек. В 2002 году заболеваемость снизилась до уровня 2000 года, а в 2003 снова наблюдается небольшой подъем. В связи с тем, что больные в лабораторию поступают добровольно, на основании плохого самочувствия или определённых подозрений, данную статистику можно считать близкой к реальной заболеваемости по нашему региону.
Различные показатели выявляемости трихомонад у мужчин и женщин обусловлены рядом причин. Доминирующими, среди которых являются следующие: женщины серьёзнее относятся к собственному здоровью, а, следовательно, чаще посещают врачей. Анатомия женских гениталий такова, что для трихомонад создаются хорошие условия, и они могут быть не замечены длительное время. В таких случаях наступает трихомонадо - носительство, а присутствие «стёртых» симптомов часто принимается за норму и связывается с циклами. Количество трихомонад у женщин всегда велико. Поэтому для диагностики достаточно взять мазок - отпечаток в определённый период.
У мужчин инфицирование не может остаться не замеченным, т.к. после попадания возбудителя первая фаза воспаления развивается в уретре. А уретрит чётко ощущается в момент мочеиспускания. По этой же причине много паразитов вымываются, а следовательно их сложнее выявить при заборе материала.
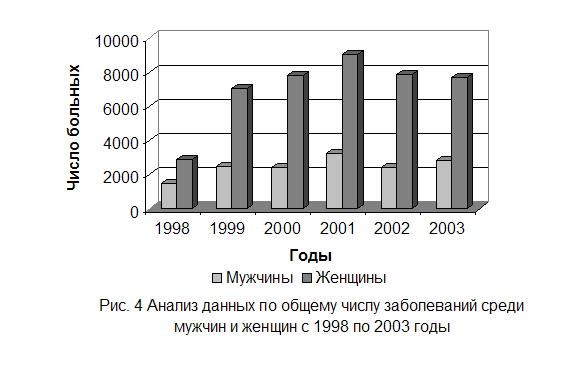
Таким образом, за 1998 год возбудитель впервые выявлен у 4338 человек, среди них: мужчины – 1462, женщины – 2867. За 1999 год, заболело 9543 человек, из которых: мужчин – 2479, женщин – 7064. В 2000 году общее число больных оставило 10242 человек. Среди них: мужчин – 2411, женщин – 7831. Общее количество больных в 2001 году составило 12265: мужчин – 3243, женщин – 9022. За период 2002 года всего заболело 10329 человек, где мужчины составили 2448, женщины – 7881. 2003 год дал общее число больных 10541, из которых мужчины составили 2833, а женщины – 7708.
Выводы
1. При диагностике трихомоноза наибольшее значение следует придавать методу микроскопии окрашенных препаратов. Для подтверждения результатов можно воспользоваться ПЦР диагностикой. Делать заключение на основе культурального метода нельзя. Ни один из существующих методов диагностики не обладает абсолютной информативностью.
2. Надёжность диагностики трихомоноза у мужчин и женщин различна. Вероятность обнаружения паразитов у женщин значительно выше.
3. Пик заболеваемости трихомонозом по Одесскому региону приходится на 2001год, наименьший показатель отмечался в 1998 году. Начало 2004 года характеризуется небольшим подъемом заболеваемости.
Список литературы
1.Абдумаликов Р.А. Комплексный способ терапии больных мочеполовым трихомониазом: Дисс... канд. мед. наук. – М., 1995. – 4, 12 – 14,16,19-24 с.
2.Адаскевич В.П. Инфекции, передаваемые половым путем. - Нижний Новгород: Медицинская книга, 1999. - 416,417,419,421с.
3.Анчупане И.С. Урогенитальный трихомониаз и смешанные трихомонадно-гонококковые инфекции: Автореф. дисс. ... канд. мед. наук. - М., 1992. – 4,6,12,32-36 с.
4.Аковбян В. А., Прохоренко В. И. Болезни, передаваемые половым путем: Уроки прошлого и взгляд в будущее // Вестн. дерматол. – 1995. - №3. – С. 16-19.
5.Беднова В.Н., Погорельский Л.В., Васильев М.М. и др. Тактика обследования и терапии больных инфекционными урогенитальными заболеваниями, осложнёнными дисбактериозом (пособие для врачей). М.: Медицина, 1996. - 14,16,19-21,24,32 с.
6.Беднова В.Н., Васильев Н.М. Применение протеолитических ферментов для лечения трихомониаза.//Вестн. дерматол. и венерол. -1992. -№2. -с.15-24.
7.Борисов Л. Б., Козьмин-Соколов Б. Н., Фрейдлин И. С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. - Москва: Медицина, 1993. – 7-9 с.
8.Бухарин О.В., Усвяцов Б.Я. Бактерионосительство. Москва: Медицина, 1996.- 206-214 с.
9.Васильев М. М. Особенности клиники мочеполового трихомоноза, совершенствование диагностики и лечения (клинико-экспериментальное исследование): Автореф. дисс.... докт. мед. наук. – М., 1990. –10-16,18,28 с.
10.Вахнина Т.Е. Совершенствование лабораторной диагностики мочеполового трихомониаза: Автореф. дисс....канд. биол. наук. - М., 1990. – 8,11,13-15,21 с.
11.Громыко А. И. Эпидемия заболеваний, передаваемых половых путем в странах Восточной Европы // ЗППП. – 1996. - №6. – С. 22-25,27.
12.Делекторский В.В., Хабаров В.А., Скуратович А.А. и др. // 5-й Всероссийский съезд дерматологов: Тезисы докладов. – В.: Медицина, 1983. – С. 4, 9,11,83.
13.Земцов М.А. Современные методы лечения мочеполового трихомониаза и трихомонадно-хламидийной инфекции у женщин: Автореф. дисс....канд. мед. наук. - М., 1995. - 19,20,21с.
14.Кисина В.И., Беднова В.Н., Погорельская Л.В. Тактика обследования и терапии больных инфекционными урогенитальными заболеваниями, осложненными дисбактериозом. Пособие для врачей. - Москва: Медицина, 1996.-14-22 с.
15.Клименко Б. В. Трихомоноз. -Москва: Медицина, 1987.–33, 41, 44, 160, 164, 165, 169, 170-174, 176,179 с.
16.Кожные и венерические болезни: Справочник / Под ред. О.Л. Иванова. – М.: Медицина, 1997. – С. 352, 355, 357, 359.
17.Курашвили Н.В. Изучение некоторых биологических и иммунологических сдвигов у больных с трихомониазом свойств: Автореф. дисс....канд. биол. наук. -Т., 1989. - 3-21,23,25с.
18.Машковский М. Д. Лекарственные средств. Пособие для врачей. В 2 томах. – Т. 2 . – Х.: Торгсинг, 1998. – 372-373 с.
19.Межевитинова Е.А. Трихомонадный вульвовагинит: клиника, диагностика и лечение. – Москва: Медицина, 1999. -17-22,24,25 с.
20.Мешков А.М. Комплексный метод лечения больных с воспалительными заболеваниями урогенитального тракта хламидийной и уреаплазменной этиологии: Автореф. канд.мед. наук. - М., 1987. – 12,13,17-22с.
21.Микробиологические питательные среды. Справочник/Под ред. М. М. Меджидова. – М.: Медицина, 1989. – С 75-76.
22.Овчинников М. Н., Беднова Н. В., Делекторский В. В. Лабораторная диагностика заболеваний, передающихся половым путем. – Москва: Медицина, 1987. – 300-302,304 с.
23.Павлов С. Т., Шапошников О. К., Самцов В. И., Ильин И. И./Кожные и венерические болезни / Под ред. О. К. Шапошникова. – М.: Медицина, 1985. – С. 368,372-375.
24.Павлович С. А. Медицинская микробиология. – Минск: Вышэйшая школа, 1997. – 125,126 с.
25.Панкратов В. Г., Панкратов О. В., Стрельцов О. Е., Барцевич Е. В. Лечение урогенитального трихомоноза // Медицинские новости. – 1996. - №4. – С. 47-50.
26.Палканов В. С., Глазкова Л. К. Воспалительные заболевания гениталий у девочек и девушек. Учебное пособие для субординаторов акушеров-гинекологов, педиатров и врачей – интернов. – Свердловск: Изд. Свердловского медицинского института, 1990. – 83-89 с.
27.Поздеев О. К. Медицинская микробиология. – Москва: ГЭОТАР – МЕД., 2001. – 533 , 534 с.
28.Реброва Р.Н. Грибы рода CANDIDA при заболеваниях негрибковой этиологии. - Москва: Медицина, 1989. - 128-132 с.
29.Лечение заболеваний, передаваемых половым путем / под. ред. Васильєва М. М. – М.: Медицина, 1985. – 133,135,136,138 с.
30.Руководство по лабораторной диагностике вирусных и риккетсиозных болезней / под ред. проф. П. Ф. Здродовского, проф. М. И. Соколова. – М.: Медицина, 1965. –С. 87.
31.Скрипкин Ю. К., Машкилейсон А. Л., Шарапова Г. Я. Кожные и венерические болезни. – Москва: Медицина, 1995. – 464, 467 с.
32.Слюсарев А. А. Биология с общей генетикой. – Москва: Медицина, 1978. – 298с .
33.Тихомиров А.Л. Тиберах. Лечение заболеваний, передаваемых половым путем. - Москва: Медицина, 1988. - 14, 15, 18, 21-24,36 с.
34.Худайбердиев Н.А. Влияние хронического мочеполового трихомониаза на репродуктивную функцию мужчин. – Москва: Медицина, 1989, - 86-88 с.
35.Шакиров М. Т. Заболевания, передаваемые половым путем, у мужчин – гомосексуалистов (клинико-лабораторное, медико-социологическое, электронно-микроскопическое исследование): Автореф. дисс....мед. наук. – М., 1991. – 9-18,24,30 с.
36.Щербакова Н.И., Брагина Е.Е. Моделирование смешанной хламидийно - трихомонадной инфекции "in vitro". Хламидии (гальпровии) и хламидиозы // Вестн.дерматол.венерол. – 1982. - №3. – С. 19-22.
37.Юдина И.Ф., Имшенецкая Л.П., Добровольская Л.И. Диагностика трихомоноза. – Москва: Медицина, 1988. -71-74 с.
38.Яговдик Н. З., Хилькевич Н. Д. Ассоциированные уреаплазная и трихомонадная инфекции у мужчин, больных гонореей // Вестн. дерматол. - 1992. - №11.– С. 47-51.
39. Справочник по венерическим болезням / под.ред. Н. З. Яговдика. – М. – Беларуська навука, 1998. – с. 275 – 285.
40.Яцуха М.В. Некоторые аспекты эпидемиологии трихомоноза.//Вестн. дерматол. и венерол. – 1989. - №1. – С. 9-36.
41.Fouts A., and S.J.Kraus. Trichomonas vaginalis : reevaluation of its clinical presentation and laboratory diagnosis. // J.Infect. Dis., 1990.-v.14,№9. -Р.137-143.
42.Lindmark D.G at al. Carbohydrate, energy and hydrogenosomal metabolism of Trichomonas foetus and Trichomonas vaginalis. // J.Protozool. – 1989.-v.36, №2. -Р.214-216.
43.Lin P.R., Shao M.F., Liu J.Y. One-tube, nested - PCR assay for the detection of Trichomonas vaginalis in vaginal discharges. Ann. Trop. Med. Parasitol. 1997.- v.19, РРРтлиорирпмршпппрпР.437-440.
44.Madico G., Quinn T.C., Rompalo A. et al. Diagnosis of Trichomonas vaginalis infection by PCR using vaginal sw. samplas. // J. Clin. Microbiol. -2000.-v.36, №11.- Р.320-329.
45.Okayama T., Takahashi R., Mori M et al. Polymerase chain reaction amplyfication of Trichomonas vaginalis DNA from Papanicolau strain smeas. Diagn. Cytopathol. 1998.- v.19, 6.- Р.437-440.
46.Paterson BA, Tabrizi SN, Garland SM, et al. The tampon test for trichomoniasis: a comparison between conventional methods and a polymerase chain reaction for Trichomonas vaginalis in women. Sex Transm Infect 1998.- Р.136-139.
47.Petrin D., Delgaty K., Bhatt R., Garber G. Clinical and micribiological aspects of Trichomonas vaginalis.// Clin. Microb. Reviews. 1998.-v.11, No 2.- Р. 300-317.
48.Ryu J.S., Chung H.L., Min D.Y. et al. Diagnosis of trichomoniasis by polymerase chain reaction. Yonsei Med. J. 1999.- v.40, 1.- Р.56-6 …
My phone in Odessa: +380667708667


