
3.4 Определение молекулярной массы.
Молекулярную массу ферментов Penicillium wortmannii 2091 определяли методом гель-фильтрации на сефадексе У-100 [8].
Установлено, что соотношение объёма элюента, необходимого для выноса исследуемого белка из колонки (V – объём элюента) и объёма элюата, размещающемся в свободном (не занятом гранулами сефадекса) пространстве колонки (V0 – свободный объём), обратно пропорционально величине молекулярной массы белка. Для расчёта использовали формулу:
LgM=5,941-0,847 V/V0
Молекулярная масса протеиназы 1 оказалась равной 34500, протеиназы 2 – 20800, т.е. обе фракции относятся к низкомолекулярным белкам.
3.5 Исследование процессов кислотной и термической инактивации.
Изучение термо- и рН-стабильности ферментов часто несёт прикладной характер.
Исследование этих характеристик проводится остаточной активностью фермента после выдержки его раствора в течение некоторого времени при определённых рН и температуре [11].
Нами были проведены исследования кинетики кислотной и термической инактивации протеиназ Penicillium wortmannii 2091 и рассчитаны кинетические параметры этого процесса.
При изучении термо- и рН –стабильности раствор препарата выдерживали в фосфатном буфере в диапазоне рН от 5,0 до 12,0 и температур от 30 до 60оС. Периодически отбирали аликвотные доли раствора и определяли остаточную протеолитическую активность.
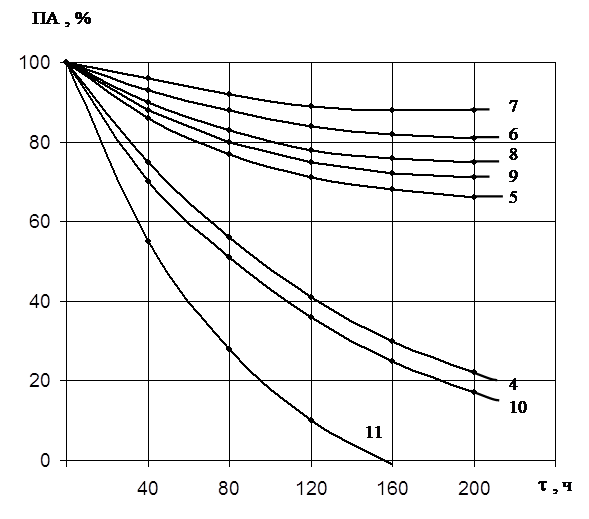
Полученные результаты по инактивации обоих ферментов показали, что протеиназа 1 сохраняет активность в широком диапазоне рН. При значении рН 7,0 через 200 часов фермент сохраняет около 90% активности (рис.4). При значениях рН 6,0 – 9,0 активность фермента снижается до 70 – 75%, это указывает на то, что фермент в указанном интервале не подвержен автолизу, а, следовательно, его нативная конформация обладает высокой стабильностью. При значениях рН ниже 6,0 и выше 11,0 каталитическая активность фермента быстро снижается.
Во всех случаях ПА/КлА-const, это свидетельствует о том, что мы имеем дело с одним ферментом.
Термическую инактивацию протеиназ изучали в интервале температур 30 – 60оС. Протеиназа 1 в области высокой рН-стабильности инактивируется почти полностью при температуре 60оС в течение 60 часов, в то время как протеиназа 2 при этой же температуре инактивируется полностью уже за 3 часа. Данные свидетельствуют о высокой термостабильности протеиназы 1. Инактивация протеиназы 2, происходящая при высокой температуре, по-видимому, определяется процессом разворачивания белковой глобулы.
Протеиназа 1, обладающая коллагенолитическим действием, нас интересует с практической точки зрения, поэтому были рассчитаны некоторые кинетические характеристики для этого фермента.
Если предположить, что в каждом элементарном акте процесса инактивации фермента под действием Н+ - ионов участвует одна его молекула, то кислотную инактивацию можно представить в виде реакции первого порядка. Кинетическое уравнение первого порядка имеет вид:
2,303 lg E0/E=K,
где Е0 – исходная активность фермента
Е – активность в момент времени
К – константа скорости инактивации, характеризующая потерю активности в течение часа, час-1.
 |
|||
|
|||
Остаточную активность выражали в процентах от исходной и затем использовали в расчётах констант инактивации. Величину находили, как среднее из 5 – 6 определений (табл.2).
Таблица 2.
Кислотная инактивация протеиназы 1 при температуре 500С.
| t, ч | Значения рН | |||||||
| 5,0 | 7,0 | 9,0 | 11,0 | |||||
| Е |
К*103ч-1 |
Е |
К*103ч-1 |
Е |
К*103ч-1 |
Е |
К*103ч-1 |
|
| 0 | 100 | 2 | 100 | 2 | 100 | 2 | 100 | 2 |
| 12 | 65,1 | 37,0 | 100 | 2 | 100 | 2 | 63,2 | 38,1 |
| 24 | 45,2 | 33,6 | 92,3 | 2,33 | 92,3 | 2,33 | 42,3 | 36,0 |
| 48 | 16,8 | 37,7 | 88,0 | 2,54 | 87,8 | 2,54 | 18,1 | 36,3 |
| 96 | 7,6 | 36,8 | 81,0 | 2,23 | 81,5 | 2,19 | 7,0 | 37,1 |
| 120 | 6,7 | 35,7 | 66,3 | 2,50 | 68,2 | 2,30 | 6,5 | 37,7 |
| 144 | 6,5 | 33,1 | 62,2 | 2,56 | 60,9 | 2,54 | 6,0 | 34,0 |
Как видно из табл.2, при определённом рН, значения констант достаточно близки друг к другу, максимальное отклонение от средних значений не превышает 10 – 15%, что вполне допустимо в исследованиях кинетики химических реакций. Это свидетельствует о том, что процесс инактивации протеиназы 1 является реакцией первого порядка. Различия в значениях при рН 5,0 и 11,0 и при рН 7,0 – 10,0 на целый порядок ещё раз указывают на лабильность фермента в слабо - кислой и слабо - щелочной зонах.
Исследования термической инактивации протеиназы 1 при различных значениях рН позволили рассчитать константы инактивации для температур 30, 40, 50, 60оС, а затем найти термодинамические параметры этого процесса.
Термодинамические расчёты были проведены только для вышеуказанных температур (табл.3).
Таблица 3.
Термодинамические характеристики активированного комплекса
протеиназы I.
|
t, oC |
PH |
Еакт |
DН¹ |
DF¹ |
DS Дж*К-1*моль-1 |
|
Дж*моль-1 |
|||||
| 30-60 | 5,0 | 245,8 | 244,6 | 53,2 | 600,3 |
| 30-40 | 7,0 | 75,6 | 72,0 | 68,1 | 13,6 |
| 40-60 | 7,0 | 300,5 | 298,2 | 60,0 | 734,9 |
| 30-40 | 9,0 | 72,4 | 71,0 | 69,9 | 9,9 |
| 40-60 | 9,0 | 295,9 | 294,1 | 60,0 | 723,9 |
| 30-40 | 11,0 | 255,9 | 253,6 | 54,9 | 624,3 |
Поскольку инактивация протеиназы была необратимой, для определения энтальпии DН¹, свободной энергии DF¹ и энтропии DS¹ воспользовались теорией абсолютных скоростей Эйринга.
При повышении температуры скорость инактивации возрастает. Это можно объяснить тем, что тепловая энергия разрушает гидрофобные взаимодействия, которые играют важную роль в стабильности белков. В результате происходит развёртывание полипептидной цепи, что подтверждается высокими значениями DS¹ и согласуется с литературными данными.
Таким образом, изменение величины рН вызывает разрушение электростатических сил, и решающую роль в этих условиях в процессе инактивации играют, по-видимому, гидрофобные взаимодействия.
3.6 Влияние ионов металлов и ингибиторов на активный центр фермента.
Главным признаком, используемым при отношении протеолитических ферментов к тому или иному классу, является строение каталитического центра.
Отправной точкой в изучении строения активного центра, механизма катализа является идентификация функциональных групп, что достигается комплексными исследованиями и, в первую очередь, применением специфических ингибиторов. В наших опытах в качестве ингибиторов были использованы ЭДТА, монойодуксусная кислота, n-хлормеркурийбензоат натрия, фенилметилсульфатонилфторид, диизопропилфторфосфат, перманганат калия.
Растворы ферментов, содержащие 5×10-3М этих соединений, выдерживали при 30оС в течение одного часа.
Как показали результаты опытов, протеиназа 1 полностью инактивировалась ЭДТА – ингибитором металлоферментов, остальные ферменты не изменяли протеолитическую активность.
Протеиназа 2 инактивировалась монойодуксусной кислотой и n-хлормеркурийбензоатом натрия на 84 и 63% соответственно. Фермент терял активность при воздействии фенилметилсульфатонилфторидом и диизопропилфторфосфатом, это даёт возможность предположить, что протеиназа 2 относится к «сериновым». Не оказывал влияния не на одну из протеиназ перманганат калия, что свидетельствует об отсутствии в активном центре карбоксильной группы.
На основе полученных данных можно предположить, что протеиназа 1 относится к «металлоферментам», а протеиназа 2 – к «сериновым».
В дальнейшем было интересно рассмотреть влияние на протеиназы гистидина. На протеиназу 2 он не оказывал ингибирующего действия, в то время как полностью ингибировал протеолитическую и коллагеназную активности протеиназы 1. Из литературы известно, что гистидин является ингибитором коллагеназ. В связи с чем очевидно, что протеиназа 1 является ферментом, проявляющим свойства протеиназы с коллагеназным действием..
К специфическим реагентам относятся также ионы металлов. Они могут оказывать ингибирующий или активирующий эффект. В наших опытах мы использовали соли двухвалентных металлов в виде хлоридов и концентрации 0,005М. Фермент выдерживали в соли, а затем определяли остаточную активность. Ионы Mn2+, Ca2+, Ba2+ практически не оказывали никакого влияния на активность обеих протеиназ; Zn2+, Co2+ незначительно ингибировали оба фермента, ионы Cd2+, Cu2+ ингибировали протеиназу 1, а протеиназа 2 ингибировалась ионами Fe2+, Ni2+, Cd2+, Cu2+ . Результаты представлены в таблице 4.
Таблица 4.
Влияние ионов металлов на активность протеиназ Penicillium wortmannii 2091.
| Ион металла С=0,005М | Ферментная активность, % от исходной. | |
| Протеиназа I | Протеиназа II | |
|
Mn2+ |
100,0 | 95,39 |
|
Ca2+ |
100,0 | 100,0 |
|
Ba2+ |
100,0 | 100,0 |
|
Zn2+ |
95,2 | 95,2 |
|
Co2+ |
93,9 | 95,2 |
|
Cu2+ |
34,5 | 19,2 |
|
Cd2+ |
20,4 | 20,8 |
|
Ni2+ |
98,5 | 67,5 |
|
Fe2+ |
97,9 | 44,9 |
3.7 Субстратная специфичность.
В изучении протеолитических ферментов значительное место занимают исследования специфичности их действия. В литературе нет сведений, касающихся вопроса специфичности действия протеиназ грибов рода Penicillium. В связи с этим исследовалась способность протеиназы 1 к гидролизу некоторых пептидных связей.
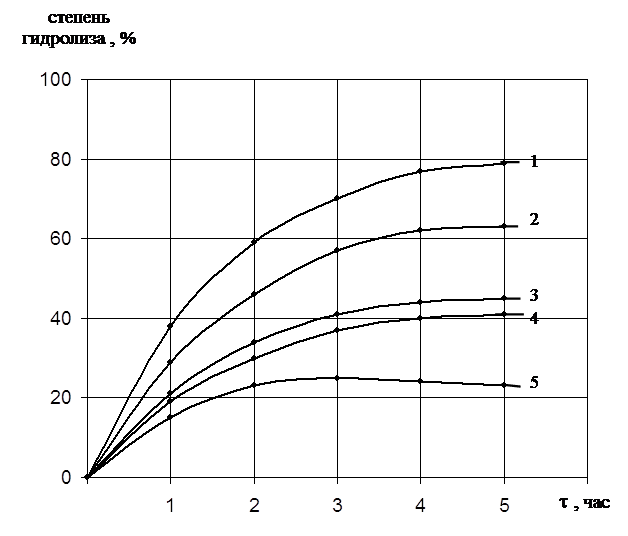
Исследования проводили на синтетических пептидах и различных белках. Результаты показали, что протеиназа 1 гидролизовала довольно широкий спектр пептидных связей. Она разрывала связи в пептидах: цис – ала, про – ала, гли – лей, гли – мет, ала – гли – гли, ала – гли – фен. Следует отметить, что гидролизу подвергались связи, характерные для белков животного происхождения. В связи с этим мы исследовали специфичность действия протеиназы на животных белках. В качестве субстратов использовались: казеин, гемоглобиин, денатурированный мочевиной, кератин, коллаген, желатина. При одной и той же концентрации фермента наиболее активно расщепляется казеин (78 – 80%) и гемоглобин (60 – 62%), затем слабее желатина и коллаген. Менее всего гидролизу подвергается кератин (22 – 25%) (рис.5).
3.8 Гидролиз коллагенсодержащего сырья: ноги птиц, шквара.
Мясная промышленность располагает значительным количеством шквары, получаемой при перетопке говяжьего и свиного жиросырья. Анализ химического состава шквары свидетельствует о значительном содержании в ней белковых веществ и подтверждает целесообразность её использования как в колбасном, так и ряде других производств. Общее содержание белка в шкваре колеблется в пределах 65 – 80%. В состав белков входят 22 – 44% коллагена и 19 – 30% эластина. Однако использование шквары ограничивалось из-за большого содержания соединительной ткани. В настоящее время соединительную ткань рассматривают не как билластное вещество, а как необходимый компонент питания [10]. В связи с этим возрастает практический интерес к рациональному и полному использованию шквары на пищевые цели, разработке путей повышения её биологической ценности. Это направление явилось основой разрабатываемой нами темы.
Для получения гидролиза шквары целесообразно использование протеиназ, расщепляющих белки в нейтральной зоне рН и действующих на коллаген.
 |
|||
|
|||