 Реферат: Вода и ее применение в современных технологиях
Реферат: Вода и ее применение в современных технологиях
По-видимому, здесь отчасти кроется причина образования в некоторых случаях так называемого донного льда, о котором подробнее будет идти речь в дальнейшем.
Как правило, различные модификации льда даже при высоких давлениях по плотности близки к плотности обычного льда (различия в плотности обычно не превышают 6%). Однако в астрофизическом центре университета в Толедо (США, штат Огайо) американскими учеными А. Дальсом и А. Венджером была открыта сверхплотная модификация льда при температуре ниже минус 173 °С и давлении (6— 8) -Ю-3 мм рт. ст. Плотность этой модификации 2,3 г/см3 (по плотности он близок к гнейсу — 2,4 г/см3). Этот лед аморфен и может играть большую роль в физике планет и комет.
Замерзание природной воды зависит от температуры, давления, минерализации (количества растворенных веществ) и изотопного состава. Так, при концентрации раствора поваренной соли NaCI 5 г/л он замерзнет при минус 0,38; 50 г/л — при минус 3,78 и, наконец, 100 г/л—при минус 7,44 °С. Дальнейшее увеличение минерализации не предохраняет раствор от замерзания, происходит процесс вымораживания, которым пользуются, например, при добыче соли. В результате образуется чистый лед, а концентрация оставшегося жидкого раствора повышается.
Каждой, температуре соответствует вполне определенная концентрация раствора. Так будет продолжаться до тех пор, пока температура не упадет до минус 21,9°С, а концентрация раствора при этом достигнет 224 г/л, после чего раствор затвердеет, образуется эвтектическая смесь кристаллов льда и соли, называемая криогидратом. По данным Н. Н. Зубова [1945], лед образуется из морской воды при минерализации 10 г/л при температуре 0,5; при 100 г/л — при 6,4, а при 260 г/л при минус 23 °С.
Лед очень прозрачен для солнечной энергии, особенно для ультрафиолетового излучения. Снег, хотя и меньше, но тоже довольно хорошо пропускает солнечное излучение. Но даже самые тонкие (1—2 мм) слои льда совершенно не прозрачны для тепловой длинноволновой радиации и земного излучения. Эта особенность имеет большое значение для нагревания воды подо льдом. Теплопроводность льда довольно высокая—53·10-4 кал/ (см · сек · °С); для сравнения: теплопроводность воды—14, а воздуха— 0,57 кал/(см · сек · °С).
излучений и т. д.
1.9 Серебряная вода и ее применение.
Еще 2500 лет назад персидский царь Кир во время походов пользовался водой, сохраняемой в серебряных сосудах. В древней Индии для обезвреживания воды от патогенной микрофлоры в нее погружали раскаленное серебро. Многовековой опыт показал, что ионы серебра подавляют размножение многих бактерий.
Впервые научные наблюдения над серебряной водой в конце XIX в. провел швейцарский ботаник К. В. Негели. С тех пор во многих странах было выполнено значительное число работ по изучению эффективных способов ее получения и применения, выпущена обильная литература о серебряной воде. В нашей стране разработаны и выпущены в продажу специальные приборы для получения в домашних условиях электролитического раствора серебра, Серебряная вода использовалась при полетах космонавтов. В Японии и в США серебро применяется для обеззараживания воды в плавательных бассейнах, а в Китае — для производства минеральных и фруктовых вод. Серебряная вода может применяться для консервирования сливочного масла, маргарина, меланжа, молока, микстур и даже для ускорения процессов старения вин и улучшения их вкусовых качеств.
Электролитический раствор серебра служит эффективным средством при лечении воспалительных и гнойных процессов, желудочно-кишечных заболеваний, язвенной болезни, холецистита, воспаления глаз, носоглотки, ожогов и т. п. Он применяется также в ветеринарии для профилактических и лечебных целей.
Глава 2 Химические свойства воды.
2.1 Характеристика природной воды.
До сих пор мы рассматривали особенности «чистой» воды, не существующей в природе. Теперь мы попытаемся дать пока краткую характеристику природной воды, в которой всегда растворены различные газообразные и твердые (а подчас и жидкие) вещества, создающие громадное разнообразие (по минеральному составу) природных растворов.
По содержанию в 1 л воды растворенных веществ различают три группы вод:
Таблица 1
Содержание в 1л. воды растворенных веществ
| Кол-во растворенных веществ, г | |
| Пресные | Менее 1 |
| Минерализованные | 1-50 |
| Рассолы | Более 50 |
В воде могут раствориться все элементы периодической системы, включая и такие почти не растворимые, как кремень (например, кварц – двуокись кремния SiO2). Все зависит от температуры, давления и присутствия в растворе других компонентов. Природные воды могут существовать в температурных пределах от близкой к абсолютному нулю (минус 273 °С, или 0°К) до примерно 2000 °С; могут испытывать давление от тысячных долей атмосферы (единицы миллиметров ртутного столба или единицы миллибар) до десятков тысяч атмосфер (порядка 30—40кбар).
2.2 Растворимость газов в воде
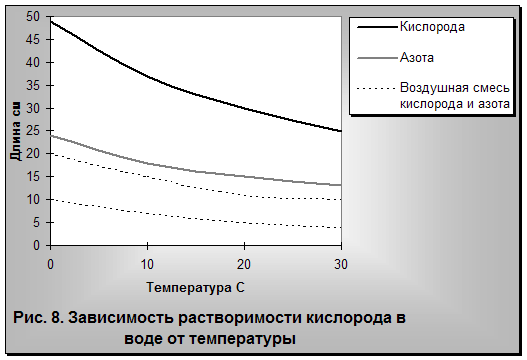
В природной воде могут быть растворены газы как воздушного (атмосферного), так и подземного происхождения. В наиболее пресной дождевой воде, прежде всего, растворяются кислород и азот. Как известно, воздушная смесь газов земной атмосферы в основном состоит из 79 частей азота и 21 части кислорода. Хотя растворимость кислорода почти в два раза выше растворимости азота, все же в воде азота растворяется почти в два раза больше, чем кислорода (рис. 8).
Растворимость в воде газов различна и зависит от ряда факторов: температуры, давления, минерализации, присутствия в водном растворе других газов. С повышением температуры до 90 °С растворимость газов в воде снижается, а затем возрастает. Так, в 1 л воды при температуре 20 °С растворяется 665 мл 4630, аммиака—I 300000. Как видно из этих примеров, растворимость зависит и от состава самого газа.
Повышение давления влечет за собой увеличение растворимости газов. Например, при давлении 25атм в 1 л воды растворяется углекислого газа 16,3 л, а при 53 атм — 26,9.
При повышении минерализации воды растворимость газа падает. Так, при 0°С растворимость кислорода в 1 л воды с минерализацией менее 1 г/л составляет 49 мл, а при минерализации 30 г/л*—только 15, т. е. в три раза меньше.
 |
Из всего сказанного можно сделать вывод о том, что растворимость газа в природной воде при постоянных температуре и степени минерализации прямо пропорциональна давлению газа на жидкость, для газовых смесей она пропорциональна давлению каждого газа в отдельности. Но это справедливо для сравнительно небольших давлений. При значительных давлениях, например на больших глубинах в океане, где давление подчас достигает сотен и даже тысячи атмосфер, на растворимость газов в воде влияет не парциальное давление отдельных газов, а общее давление всего столба воды, но об этом речь впереди.
В растворенном газе дождевой воды углекислоты в 33 раза больше, чем в воздухе, а кислорода в два раза больше.
Углекислый газ поступает в атмосферу (наземную и подземную) преимущественно за счет окисления, брожения и гниения органических остатков и дыхания водных организмов. В атмосфере его содержание при парциальном давлении 0,0003 атм невелико - около 0,03%.
В 1 л чистой воды при таком давлении и температуре 15 °С может раствориться всего лишь 0,59 мг углекислого газа. В земных недрах на значительных глубинах его содержание может достигать очень больших значений, и источником этого газа чаще служат глубинные процессы выделения его из вещества мантии и нежней литосферы.
2.3 Растворимость твердых веществ в воде.
Процесс растворения твердых веществ в воде можно рассматривать как борьбу двух электростатических сил с противоположными зарядами, присущих ионам твердого вещества, с одной стороны, и ионам и молекулам воды — с другой. На рис. 9 показана схема процесса растворения кристалла поваренной соли (NaCI). Оторванные от кристалла заряженные ионы хлора и натрия окружаются молекулами воды и образуют вокруг иона твердого вещества гидратную оболочку. Иногда она сохраняется даже в том случае, когда твердое вещество выпадает из насыщенного раствора в осадок. Например, выпадающий из раствора при его пересыщении сульфат кальция (Са[S04]) захватывает воду (называемую кристаллизационной) и становится гипсом (Ca[S04] · 2H20). Процесс может идти и в обратную сторону. Аналогичное происходит и с гематитом (железным блеском Fe2Оз), переходящим при гидратации в лимонит (бурый железняк HFeO2 · nH2O, где п достигает 4) и т. п.

Процессы гидратации могут происходить настолько быстро и сопровождаться столь значительным увеличением объема, что приводят к нарушениям земной коры, подобно тектоническим дислокациям.
Растворы представляют собой сложные промежуточные системы между физическими смесями и химическими соединениями. Процесс растворения — процесс диффузионный. При достижении предела растворения (при известных температуре и давлении) наступает динамическое равновесие между количествами как растворяемого вещества, так и выпадающего из раствора, образуется насыщенный, или концентрированный, раствор. Д. И. Менделеев относил процесс растворения не к физическим, а к химическим процессам на том основании, что нередко при растворении выделяется тепло. Это происходит вследствие химического взаимодействия между растворяемым веществом и растворителем. Процентное содержание воды в некоторых минералах очень велико. Например, мирабилит Na2S04·10H20 содержит 56 вес. % воды, гидробазалюминит А14[(ОН)10SO4]3 · 36Н2O — 60, сода Na2СOз·10H2О — 55 и т. д.
Твердое вещество образует водный раствор из молекул и ионов с диаметром 1—10А. Но в воде могут содержаться и более крупные частицы: от 10 до 100А, которые образуют чаще всего не истинные, а коллоидные растворы. Если находящиеся в воде частицы еще крупнее, то они не образуют растворов, а создают механические суспензии, взвеси.
Химический состав природных растворов весьма разнообразен. Существует множество классификаций их, построенных по разным принципам. Форма выражения результатов анализов может быть различной: солевая, окисная, атомная и ионная. Последняя, хотя, как и другие, условна, однако в настоящее время признана наиболее удобной, поскольку позволяет выражать все, что содержится в воде, вплоть до живых организмов. Именно так и стремился поступать автор классической монографии о природных водах академик В. И. Вернадский. По его классификации природные воды разделялись на 485 видов минералов группы воды (гидридов), причем общее их количество, по его мнению, в действительности должно превысить 1500. Конечно, для практических целей такая классификация затруднительна.
В настоящее время все природные воды по пре" обладающему аниону делят на три класса: 1) хлоридные, 2) сульфатные и 3) гидрокарбонатные.
Каждый класс подразделяется в свою очередь на три группы: 1) кальциевую, 2) магниевую и 3) натриевую, т. е. классификация проводится по катионам. Группы можно делить еще по трем типам, но мы эту классификацию рассматривать не будем. По преобладающему растворенному газу воды могут быть подразделены на азотные, сероводородные, углекислые и т. д.
Самыми главными и наиболее распространенными компонентами в природных
растворах являются хлор, а затем натрий, далее следуют ионы сульфатный ![]() ,гидрокарбонатный HCO3- и карбонатный
,гидрокарбонатный HCO3- и карбонатный ![]() , кальций Са2+,
магний Mg2+ и др.
, кальций Са2+,
магний Mg2+ и др.
На рис. 11 показана зависимость растворимости некоторых солей хлора от температуры. Кривые недвусмысленно показывают, что из четырех солей хлора наибольшей растворимостью обладает хлористый кальций, а наименьшей хлористый натрий.
Насколько возрастает растворимость солей с повышением температуры и давления, рассмотрим на примере самого распространенного в водной среде вещества — хлористого натрия NaCl. При температуре 10°С и давлении 1 бар он растворяется предельно—257 г/кг (насыщенный раствор), а при температуре 500 0С и давлении 1 кбар—в 1571 раз больше (561000 г/кг), т. е. по массе вода как растворитель в 56 раз легче, чем растворяемая соль. В большинстве случаев то же самое происходит и с другими солями. Однако встречаются и исключения. В качестве примера можно привести хромовокислый кальций СаСrO4, растворимость которого при температуре 0°С 15,4, а при 100 0С—только 7,1 г/кг. Так же ведут себя гипс CaSO4 · 2H2O в интервале температур 40—100°С, сульфат натрия Na2S04 при 25—100°С и некоторые другие соли.
2.4 Взаимодействия воды с растворенным в ней веществом.
Выше было сказано, что при некоторых условиях вода способна расщепляться на два иона: положительно заряженный гидратированный катион Н+ (Н3О+) и отрицательно заряженный анион ОН- (называемый также гидроксилом). Но вода способна не только расщепляться сама, но и расщеплять другие вещества, в ней растворенные, вступая при этом в обменные реакции с присоединением элементов воды (ОН- и Н+. Этот процесс носит название гидролиза. В качестве одного из примеров можно привести гидролиз хлористого железа, протекающий по следующей схеме:
FeCl3+ЗН2О Fe(OH)3 + ЗНСl.
В результате гидролиза мы получаем гидрат окиси железа и соляную кислоту.
Останавливаться сейчас подробнее на гидролизе мы не будем, но просим его запомнить для лучшего понимания последующего. Отметим лишь, что гидролизом объясняются белящие свойства хлора, моющее действие мыла. Гидролиз имеет большое применение в промышленности: в паточном производстве, при получении спирта из древесины и во многих других областях производства.
Учитывая тесный контакт подземной воды с вмещающими ее породами и ее высокую растворяющую способность, естественно ожидать влияния на формирование химического состава раствора, каким является природная подземная вода, химического состава вмещающих воду пород. Это иногда и наблюдается в верхних горизонтах литосферы до глубин, различных в разных местах, но не превышающих зоны возможного проникновения в породы современных поверхностных вод. Разумеется, многое здесь зависит от растворимости пород и от целого ряда превходящих факторов, таких, как температура, давление, биохимические процессы, наличие тех или иных уже растворенных веществ, в частности растворенных или свободных (называемых спонтанными) газов.
Во всяком случае, при циркуляции воды в известняках или доломитах и при их выщелачивании образуется гидрокарбонатно-кальциевая, жесткая, вода, а в случае смывания залежей поваренной соли, хлоридно-натриевая. Образование гидрокарбонатно-натриевых (содовых, Na2HCO3) вод объясняется иногда разложением полевых шпатов (например, плагиоклаза NaAlSi3O8) в присутствии углекислого газа СО2. Воды сульфатного класса в присутствии кислорода могут образовываться при их циркуляции в трещиновато-пористых породах, богатых сульфидными минералами.
Во всех перечисленных случаях повышенные минерализации вод (до рассолов включительно) чаще возможны при интенсивном природном выпаривании подобных растворов. Например, в озерах в районах с жарким климатом. Мы не разделяем мнение многих исследователей, привлекающих эти процессы для объяснения высоких концентраций глубинных рассольных вод.
Химический состав природных растворов выражается самыми различными формулами. Вот как с помощью формулы Курлова могут быть выражены результаты анализа морской воды:
![]()
Как отмечалось выше, наиболее предпочтительной формой выражения результатов анализа воды является ионная. При этом содержание того или иного иона дается в граммах или миллиграммах на литр воды. Однако для полной характеристики свойств воды ионная форма недостаточна. В связи с этим наряду с ионной пользуются миллиграмм-эквивалентной формой. Пересчет данных анализа на миллиграмм-эквивалентную форму осуществляется делением количества миллиграммов каждого иона в 1 л воды на его эквивалентную массу. Например, разделив 10722 мг натрия на его эквивалентную массу, равную 23, получим 466 мг-экв. натрия. Сумма миллиграмм-эквивалентов для катионов и анионов должна быть одинаковой, поскольку каждому эквиваленту катиона соответствует эквивалент аниона.


