
Препарат "мидазолам"
|
Группы: |
|
||||
|
Действие: |
|
||||
|
Показания: |
|
||||
|
Побочный эффект: |
|
||||
|
Время |
|
||||
|
Антагонисты |
|
||||
|
Введение: |
|
||||
|
Синонимы: |
|
Препарат "мезапам"
|
Группы: |
|
||
|
Действие: |
|
||
|
Показания: |
|
||
|
Антагонисты |
|
||
|
Синонимы: |
|
Препарат "дикалий клоразепата"
|
Группы: |
|
||
|
Действие: |
|
||
|
Показания: |
|
||
|
Антагонисты |
|
||
|
Синонимы: |
|
Дерево группы "бензодиазепиновые агонисты БД-Р"
A. нитразепам (радедорм, эуноктин) 24ч
B. лоразепам (ативан) 15ч
C. нозепам (оксазепам, тазепам) 15ч
D. темазепам (рестроил) 15ч
E. триазолам 2ч
F. диазепам (сибазон, седуксен, в...) 35ч
G. феназепам 35ч
H. флуразепам (далман) 35ч
I. клоназепам (антелепсин)
J. бензодиазепиновые агонисты (транквилизаторы)
Дерево группы "серотониновые агонисты (транквилизаторы)"
Препарат "буспирон"
|
Группы: |
|
||
|
Действие: |
|
||
|
Механизм: |
|
||
|
Показания: |
|
||
|
Побочный эффект: |
|
||
|
Время |
|
СПИСОК ЛИТЕРАТУРЫ
И ДРУГОЙ ИСПОЛЬЗУЕМОЙ ИНФОРМАЦИИ
1. Руководство к лабораторным занятиям по фармацевтической химии Под ред. А.П. Арзамасцева. М. 2001
2. Журнал Кремлевская медицина 1993г
3. Интернет сервер www.neuro.net.ru
4. Справочник по фармакологии Машковский 2001г
5. Государственная фармакопеея 10 изд.
6. Государственная фармакопеея 11 изд.
7. Интернет сервер www.medinfo.ru
8. Беликов «О фармацевтической химии»
9. Российский медицинский журнал www.rmj.ru
10. Интернет сервер www.medline.ru
11. «Фармакология» Харкевич 2001г
12. Интернет сервер www.medlook.ru
13. Справочник по фармакологии Видаль 2001г
ПРИМЕНЕНИЕ ТРАНКВИЛИЗАТОРОВ БЕНЗОДИАЗЕПИНОВОГО РЯДА ДЛЯ КОРРЕКЦИИ СТРЕССОРНЫХ РАССТРОЙСТВ
Вместе с тем для коррекции стрессорных расстройств широкое применение в клинической практике нашли транквилизаторы бензодиазепинового ряда, которые, как выяснилось, сами способны нарушать процессы обучения и памяти (Т.А.Воронина, 1992), подавляя тем самым активную адаптацию организма (В.И.Петров, 1997). Кроме того, не всегда принимается во внимание, что использование бензодиазепиновых препаратов должно быть ограничено у данного контингента в связи со склонностью к аддиктивному поведению, а также ситуационному употребление алкоголя, наркотиков, других психоактивных веществ.
ХИМИЧЕСКИЕ СВОЙСТВА И ОПРЕДЕЛЕНИЕ ПОДЛИНННОСТИ
Производные 1,4-бензодиазепина
Химическое строение, физические и физико-химические свойства
Производные 1,4-бензодиазепина представляют собой группу лекарственных средств, содержащих конденсированную систему бензольного и семичленного 1,4-диазепинового колец:
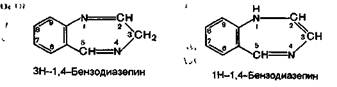
Хлозепид — производное ЗН-1,4-бензодиазепина. Остальные препараты являются дигидропроизводными 1Н-или ЗН-1,4-бензодиазепина, причем дигидропроизвод-ные имеют одну и ту же химическую структуру, которую можно назвать как 2,3-дигидро-1Н-бензодиазепином, так и 1,2-дигидро-ЗН-бензодиазепином:
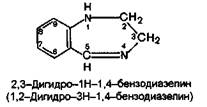
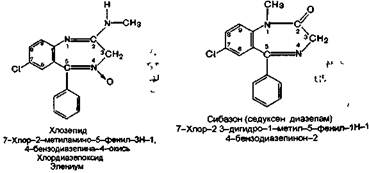
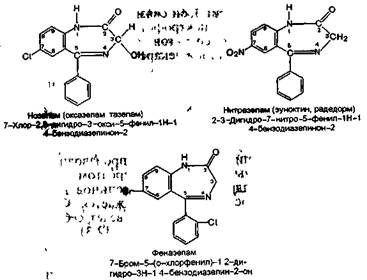
К данной группе относятся следующие препараты;
В структуре производных бензодиазепина имеется азометиновая группа — C5=4N~.
Все дигидропроизводные содержат при С-2 карбонильную группу, которая вместе с атомом азота N-1 образует амидную (лактамную) группу.
Препараты данной группы при С-5 содержат фениль-ный радикал, при С-7 — атом галогена (хлор или бром) или нитрогруппу (нитразепам).
Заместитель при С-1 (метильная группа) содержится только у сибазона, а при С-3 — у нозепама (оксигруппа).
Препараты этой группы, за исключением нитразепама и хлозепида, представляют собой белые или белые со слегка желтоватым или кремоватым оттенком кристаллические порошки. Нитразепам — светло-желтого цвета кристаллический порошок; хлозепид — белый или светло-желтый мелкокристаллический порошок. Все лекарственные средства данной группы практически нерастворимы
в воде, трудно растворимы в 95 % спирте, мало — в эфире и хлороформе (сибазон растворим в хлороформе).
Все препараты характеризуются определенной температурой плавления.
В электронных спектрах 1,2-дигидро-ЗН-1,4-бензоди-азепин-2-онов обычно имеется три полосы поглощения с максимумами при 200—215, 220—240 и 290—330 нм. Две первые полосы соответствуют возбуждению ароматических хромофоров. Третью — длинноволновую — по-
лосу относят к азометиновой связи, сопряженной с бензольным ядром. УФ-спектрофотометрия используется для идентификации препаратов данной группы и количественного определения в лекарственных формах.
Химические свойства
Кислотно-основные свойства
1,4-бензодиазепины и их дигидропроизводные проявляют слабоосновные свойства (гетероатом азота N-4). При введении в ядро 1,4-бензодиазепинов карбонильных и оксигрупп основность их снижается. Феназепам, например, в среде метилэтилкетона ведет себя как слабое однокислотное основание (рКв = 12,31 ± 0,05). Основность азота в азометиновой группе сильно снижается за счет сопряжения с кольцом бензола при С-5.
Присоединение протона при взаимодействии с кислотой происходит за счет гетероатома азота N-4. Исключение составляет хлозепид, у которого положительный заряд при присоединении протона распределяется по триаде, между гетероатомом азота N-1 и атомом азота метиламиногруппы N-2.
Слабоосновные свойства бензодиазепинов лежат в основе их количественного определения методом кислотно-основного титрования в не водных средах.
Бензодиазепины как азотсодержащие основания могут давать реакции с осадочными реактивами. Например, сибазон образует розовый осадок с аммония рейне-катом в кислой среде:
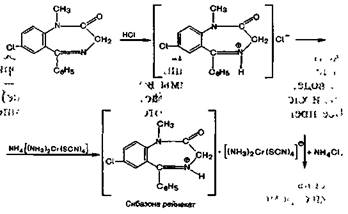
Методика. 0,05 г препарата растворяют в 2 мл разведенной кислоты хлороводородной, прибавляют 2 мл раствора аммония рейнеката. Образуется розовый осадок, растворимый в ацетоне.
С концентрированными кислотами (серной, хлороводородной, хлорной) 1,4-бензодиазепины образуют окрашенные соли, которые флюоресцируют в УФ-свете. Это испытание используется для идентификации препаратов. С концентрированной кислотой серной сибазон дает в УФ-свете зеленовато-голубую флюоресценцию, нитразепам — голубую флюоресценцию, феназепам — ярко-зеленую флюоресценцию и желтую окраску.
Методика. К1мл раствора феназепама 3 % для инъекций прибавляют 3 капли концентрированной кислоты серной и перемешивают. Раствор окрашивается в желтый цвет. В УФ-свете раствор дает ярко-зеленую флюоресценцию.
Соединения с лактамной группой
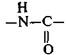
проявляют слабокислотные свойства, образуя соли при действии сильных оснований.
Наряду со слабоосновными свойствами сибазон, нозепам и нитразепам проявляют и слабокислотные свойства; они реагируют с сильными основаниями, например с диметилформамидом, образуя соответствующие анионы. Так, сибазон (слабая СН-кис-лота) и нозепам (слабая NH-кислота) образуют соответствующие депротонированные соединения (анионы): , „ *
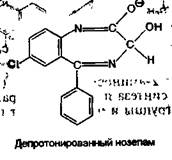
го гидролиза за счет образовавшейся первичной ароматической аминогруппы образуют соль диазония и затем азокраситель. Реакция диазотирования лежит в основе нитритометрического метода количественного определения производных данной группы, образование азокраси-теля используется для их идентификации и фотоколориметрического количественного определения. В качестве азосоставляющей применяют фенолы в щелочной среде: > резорцин (красное окрашивание), р-нафтол (оранжево-красный осадок) или ароматические амины в кислой среде: М(1-нафтил)-этилендиамин (красная окраска):
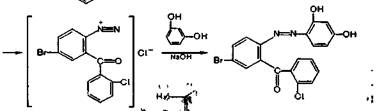
Методика. 0,02 г феназепама нагревают до кипе- , ния с 2 мл разведенной кислоты хлороводородной в те- 1 чение 3 мин и охлаждают. Полученный раствор дает характерную реакцию на первичные ароматические амины с образованием оранжево-красного осадка (ГФ XI, вьщ 1, с. 159).
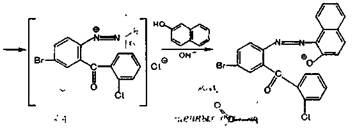
Соль диазония, полученную из нитразепама, сочетают в кислой среде с N-1-нафтилэтилендиамином; образуется азокраситель красного цвета:
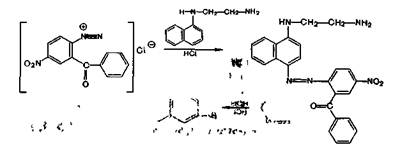
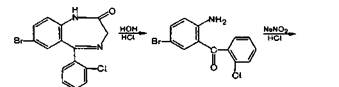
При нагревании нитразепама с цинковой пылью в кислой среде, кроме гидролитического разложения, происходит восстановление ароматической нитрогруппы до аминогруппы с образованием 2,5—диаминобензофено-на, который дает реакции диазотирования и азосочета-ния по обеим аминогруппам:
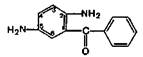
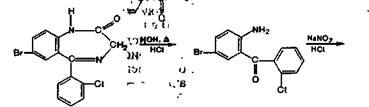
Несколько иначе протекает кислотный гидролиз хло-зепида. Вначале происходит присоединение воды по двойной связи 1—2, затем отщепление метиламина и образование амидной связи, а далее — гидролиз лактамной (амидной)связи:
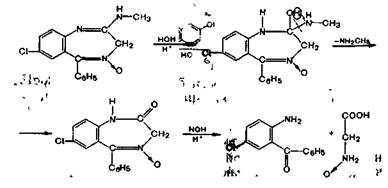
Методика. 0,05 г хлозепида нагревают до кипения с разведенной кислотой хлороводородной в течение 2 мин и охлаждают. Полученный раствор дает характерную реакцию на первичные ароматические амины с образованием оранжево-красного осадка (ГФ XI, вып. 1, с. 159).
Сибазон не дает реакции образования азокрасителя, так как при кислотном гидролизе образуется вторичная ароматическая аминогруппа.
Щелочной гидролиз. При щелочном гидролизе в жестких условиях (сплавление с натрия гидроксидом или кипячение с раствором щелочи) из амидной группы бензо-диазепинов образуется аммиак или метиламин (сиба-зон), окрашивающие влажную красную лакмусовую бумагу в синий цвет. При этом нозепам образует на стенках пробирки налет изумрудно-зеленого цвета. Реакция сплавления со щелочью используется для идентификации 1,2-дигидро-ЗН-1,4-бензодиазепин-2-онов.
При взаимодействии со щелочью при нагревании галоген переходит в ионное состояние (галогенид). Для обнаружения галогенид-ионов проводят соответствующие реакции.
Методика. 0,2 г феназепама кипятят с 10 мл раствора натрия гидроксида в течение 10 мин; выделяющийся аммиак определяют по посинению влажной красной лакмусовой бумаги; раствор подкисляют кислотой хлороводородной и фильтруют. Полученный раствор дает характерную реакцию А на бромиды (ГФ XI, вып. 1, с. 159).
Неионогенно связанные атомы галогенов (хлор — в хлордиазепоксиде, сибазоне, нозепаме; хлор и бром — в феназепаме) определяют после минерализации, для чего можно использовать нагревание с раствором щелочи (см. раздел 6.3.14.2.2) или метод сжигания в колбе с кислородом (ГФ XI, вып. 1, с. 181). Кроме того, наличие галогена определяют при сжигании крупинки препарата на медной проволоке в пламени горелки; пламя окрашивается в зеленый цвет (проба Бейльштейна).
Многие бензодиазепины образуют окрашенные плавы. При осторожном нагревании 10 мг феназепама в сухой пробирке над пламенем горелки препарат плавится с образованием плава фиолетового или красно-фиолетового цвета. Окраска плава феназепама изменяется в зависимости от значения рН среды. Так, при добавлении раствора натрия гидроксида красно-фиолетовая окраска раствора плава в 95 % спирте переходит в сине-фиолетовую, а при добавлении разведенной кислоты серной — в сине-зеленую, а затем желтую. По-видимому, при плавлении феназепама образуется соединение, имеющее свойства кислотно-основного индикатора. У структурных аналогов феназепама (сибазона, нитразепама) при плавлении образуются плавы зеленого цвета, и окраска спиртовых растворов этих плавов не изменяется в зависимости от значения рН среды. Таким образом, эта реакция позволяет отличить феназепам от других препаратов.