 Реферат: Гемоглобин эритроцитарных мембран человека
Реферат: Гемоглобин эритроцитарных мембран человека
Триггером для всех описанных выше структурных перестроек при переходах между Т- и R-формами и обратно служит присоединение или отщепление кислорода. После локального элементарного химического акта: присоединение или отщепление низкомолекулярного лиганда, окисление железа при образовании ферригемоглобина (иначе говоря, после появлении лишнего положительного заряда на железе) – возникает существенно неравновесное конформационное состояние – изменения вблизи активного центра уже произошли, а вся огромная молекула белка осталась в прежнем, еще не отрелаксировавшем состоянии. Последующая релаксация может занимать микросекунды и даже секунды. В ходе этой релаксации меняются не только физические, но и химические свойства белка, в частности скорости последующих химических актов, если они успевают произойти до полного завершения релаксации. Таким образом, описанная выше картина процессов, сопровождающих обратимое связывание кислорода гемоглобином, является лишь первым, хотя и очень важным приближением к истине. Так, например, быстрое восстановление железа в ферригемоглобине коротким (микро- или наносекунды) импульсом электронов приводит к возникновению неравновесного состояния, в котором железо уже восстановлено, но не отошло от плоскости порфиринового кольца. По спектральным и магнитным характеристикам это состояние соответствует равновесному оксигемоглобину. Релаксация гема и его ближайшего окружения с удалением железа от плоскости порфиринового кольца занимает при комнатной температуре десятки микросекунд, а полная релаксация всей белковой глобулы к равновесной Т-форме дезоксигемоглобина — сотни миллисекунд.
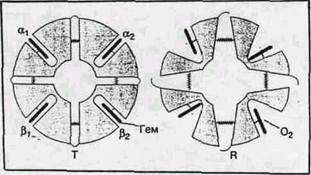
Рис. 5. Структурная схема перехода гемоглобина от Т- к R-форме
Другие реакции и функции гемоглобина При взаимодействии молекулярного кислорода с гемоглобином существует небольшая, но конечная вероятность окисления последнего: молекула О2 не присоединится, но окислит железо: Fe2+ + O2 Þ Fe3+ O2-. Поэтому при дыхании в эритроцитах непрерывно образуется метгемоглобин. Для его восстановления в эритроците существует специальная ферментативная система, восстанавливающая метгемоглобин и превращающая его в нормальный дезоксигемоглобин. При нарушении этой системы возникает тяжелое заболевание — метгемоглобинемия, при котором гемоглобин перестает быть переносчиком кислорода.
Гены, ответственные за синтез гемоглобина, могут подвергаться мутациям, меняющим структуру и функции белка. Наиболее изучена мутация, приводящая к замене только одной аминокислоты в полпептидных цепочках b-субъединиц гемоглобина. Замена глутамина на валин ведет к тяжелой болезни – серповидноклеточной анемии: эритроциты принимают форму серпа и теряют способность переносить кислород.
Присоединение кислорода меняет кислотно-основные свойства гемоглобина. Оксигемоглобин является более сильной кислотой, чем дезоксигемоглобин. Поэтому в тканях, где значительная часть гемоглобина теряет кислород и становится более сильным основанием, гемоглобин связывает образующуюся в ходе метаболических внутриклеточных процессов углекислоту. В альвеолах легких дезоксигемоглобин снова превращается в оксигемоглобин, становится более сильной кислотой и способствует отщеплению СО2. Это слегка упрощенное описание важного процесса транспорта углекислоты эритроцитами. Углекислота, освобождаемая тканями, недостаточно хорошо растворима для эффективного переноса. С помощью фермента карбоангидразы, ускоряющего прямую и обратную реакцию
СО2+Н2ОÛНСО3-+Н+ (8)
двуокись углерода превращается в хорошо растворимый бикарбонат-анион. В капиллярах тканей отщепление кислорода повышает содержание дезоксигемоглобина, связывающего протоны и смещающего, таким образом, равновесие реакции (8) вправо. Легко растворимый ион бикарбоната переносится кровью. В альвеолах легких гемоглобин оксигенируется, протоны освобождаются и равновесие (8) смещается влево. Образуется плохо растворимая двуокись углерода СО2, которая удаляется из водной фазы и выдыхается. Таким образом, гемоглобин работает как буфер с переменным значением pK. Функция гемоглобина как переносчика углекислоты не менее важна, чем его функция переносчика кислорода.
Гемоглобин – одно из наиболее хорошо изученных белков. Десятки лет исследований гемоглобина в описании и понимании физических, химических и биологических аспектов его функционирования. Огромный вклад внесли работы Макса Перутца и его сотрудников в Кавендишской лаборатории (Кембридж, Великобритания). Однако важность этих работ касается не только гемоглобина. Они послужили основой развития современных представлений о механизмах ферментативного катализа, связав непосредственно кинетику и термодинамику биохимических реакций с динамикой конформационных изменений макромолекул белка. Если отвлечься от непосредственной практической пользы полученных результатов для медицины, фармакологии, то фундаментальное значение работ по изучению механизма функционирования гемоглобина заключается в стимулировании прогресса в установлении законов протекания важнейших процессов: ферментативного катализа и внутриклеточной трансформации энергии в биологических системах. [2]
Об участии гемоглобина в мембранной организации эритроцитов свидетельствует феномен образования серповидной и других форм эритроцитов при различных гемоглобинопатиях, первооснову которого и составляет аномальное взаимодействие эритроцитарной мембраны с мутантными гемоглобинами. Не исключено, что изменение упруго-механических свойств эритроцитарных мемран при повышении отрицательного заряда их внешней поверхности происходит вследствие улучшения условий для создания и структурирования белкового слоя, формируемого с участием гемоглобина на внутренней поверхности эритроцитарных мембран. [13]
Показано, что при получении безгемоглобиновых теней эритроцитов в препаратах электронно-микроскопически обнаруживается большое количество везикул диаметром примерно 100 нм, что свидетельствует о частичной фрагментации плазматической мембраны эритроцитов. В то же время если в мембранах содержится много гемоглобина и других белков, обнаруживаемых в примембранных слоях, то фрагментации мембраны определяемой таким образом, не наблюдается. Имеются и другие доказательства стабилизирующего действия гемоглобина на эритроцитарные мембраны. Например, S.Knutton и соавторам удалось получить две фракции эритроцитарных мембран, различающихся содержанием связанного с ними гемоглобина. Ими было показано, что во фракции эритроцитарных мембран с большим содержанием гемоглобина разрушение липопротеиновой структуры мембран при их дегидротации происходит намного слабее, чем в случае с фракцией эритроцитарных мембран с малым содержанием гемоглобина. В основе изменения условий для структурирования белково-образующего примембранного слоя внутри эритроцитов может лежать изменение электрических поверхностных свойств на внешней стороне. Это возможно вследствие того, что для мембран в липидной зоне дебаевский радиус экранировки зарядов гораздо больше ее толщины, в результате поверхностные заряды с обеих сторон эритроцитарных мембран взаимно влияют друг на друга, образуя самосогласованную систему. Кроме того, условия для образования белкового слоя, стабилизирующего мембраны эритроцитов, могут изменяться и в результате защелачивания их внутренней среды, что имеет место при суспендировании эритроцитов в щелочной или неэлектролитной среде, например, сахарозной. Это может способствовать гемоглобину и другим примембранным белкам за счет изменения их свойств образовывать прочный примембранный белковый слой (в отношении гемоглобина, например, известно, что его свойства, в том числе кислородосвязывающие, сильно изменяются при варьировании рН). Вместе с тем защелачивание внутренней среды эритроцитов не всегда может служить фактором, стабилизирующим их структуру. В литературе, например, утверждают, что для эритроцитов новорожденного теленка, для которых характерно наличие фетального гемоглобина, любые экспериментальные манипуляции, результатом которых является внутриклеточное защелачивание среды, вызывают их самопроизвольный гемолиз. По мере развития организма теленка (2-3 месяца жизни) эритроциты с нормальным гемоглобином, появляющиеся взамен вытесняемых из кровеносного русла клеток, содержащих фетальный гемоглобин, становятся устойчивыми к внутриклеточному защелачиванию их среды. При этом важно отметить, что, по данным литературы, в гемолизе фетальных эритроцитов при защелачивании их внутренней среды, помимо фетального гемоглобина, определенная роль принадлежит и мембранному белку band III. [13]
Приведенные литературные данные дают основание сделать вывод о тесной взаимосвязи процессов метаболизма, трансмембранного транспорта, изменений формы и механических свойств эритроцита, что, по-видимому, позволяет организму осуществлять координированную регуляцию функционирования клетки через соответствующие рецепторные структуры, имеющиеся на наружной поверхности мембраны. [9]
Таким образом, в поддержании структурной целостности эритроцитов важное значение имеют внутренние примембранные белковые слои, структура и взаимодействие которых с эритроцитарными мембранами взаимно обусловлены и в целом представляют собой единую структурную организацию. Поэтому всякая модификация как самой мембраны, так и содержащегося в них гемоглобина в конечном счете сопровождается и модификацией этой особой организации, частным примером проявления которой может быть изменение ее механических свойств. [13] Приведенные данные побудили нас провести исследование с целью оценки количественного содержания мембрансвязанного гемоглобина эритроцитов человека и его связи со структурными белками.
материал и методы исследования
Материал исследования
Материалом настоящего исследования послужили эритроциты 124 практически здоровых лиц, проживающих в городе Курске, в возрасте от 18 до 47 лет. Набор добровольцев проводился при исключении любой соматопатологии.
У обследуемых проводился забор крови из локтевой вены в сухую стерильную посуду в количестве 5-7 мл с целью получения образов эритроцитарных мембран.
Методы исследования
Для достижения поставленной цели и решения задач настоящей работы использовался комплекс методов.
Биохимические методы.
Реактивы и биоматериалы. В работе использовались: декстран Т-500 фирмы "SIGMA" (США), HBS – целлюлоза фирмы "SIGMA" (США), гидрофосфат натрия, хлористый натрий, мочевина фирмы "Bio-Rad" (США), трис, 2 – меркаптоэтанол, персульфат аммония "Reanal" (Венгрия), додецилсульфат натрия (ДДС) фирмы "Диа-Фарм" (Россия), акриламид "SIGMA" (США), N,N¢ - метилен бисакриламид "FLUKA" (Швейцария), кумасси G – 250 фирмы "Serva" (ФРГ), бромфеноловый синий, ТЕМЕД, глицин, набор белков для определения молекулярного веса MS-2 (Россия).
Реактивы отечественного производства были марки "ХЧ" и "ОСЧ".
Получение эритроцитов. Эритроциты получали из 5 мл гепаринизированной крови по методу Бейтлера с незначительной модификацией. [14] Сначала гепаринизированную кровь отстаивали дважды в растворе PBS, содержащем 3% декстран Т –500, в течение 30 минут. Затем эритроцитарную массу подвергали дополнительной очистке, пропуская ее через колонку с HBS-целлюлозой, после чего эритроциты ценрифугировали при 3000 оборотах в минуту. Далее из полученной очищенной массы эритроцитов проводили выделение мембран.
Выделение мембран. Для получения препаратов мембран эритроциты разрушали осмотическим шоком по методу Dodge с небольшой модификацией, заключавшейся в том, что гемолиз эритроцитов и отмывку "теней" проводили двукратно в 10 мМ Na – фосфатном буфере с добавлением ингибитора протеназ PMSF. После этого мембраны эритроцитов лиофилизировали и хранили при -20°С.
Одномерный электрофорез по Лэммли. Электрофорез в присутствии ДДС проводили модифицированным методом методом Лэммли. [14] Для этой цели использовали следующие растворы:
1. 60% акриламид –0,8% метилен бисакриламид.
2. Буфер для разделяющего геля: 1 М трис – HCI (pH 8,8).
3. Буфер для концентрирующего геля: 0,5 М трис – HCI (pH 6,8).
4. 10% додецилсульфат натрия.
5. 10% персульфат аммония.
6. ТЕМЕД.
7. Электродный буфер для ЭФ: 0,025М трис, 0,193М глицин, 0,1% додецилсульфат натрия.
Растворы хранились при +4°С две-три недели. Раствор 5 готовился перед использованием.
Электрофорез проводили в пластинах ПААГ размером 180х180х1мм, приготовленных с линейным градиентом концентрации акриламида 5 - 25%.
Для приготовления одной пластины ПААГ брали: 0,85 мл раствора 1, 5,5 мл дистиллированной воды, 3,6 мл раствора 2, 101 мкл раствора 4, 5 мкл раствора 6 и 20 мкл раствора 5 (легкий раствор, 5%). В тяжелом (25%) растворе в отличие от легкого бралось 4,2 мл раствора 1 и 2,6 мл дистиллированной воды. Через смеситель эти растворы подавались перистальтическим насосом в формирователь пластины, в течение 10 минут заполняя пластину на 4 см ниже верхнего края. Сверху на полимеризующуюся смесь наслаивалось 0,5 мл дистиллированной воды. Так формировался разделяющий гель. Полимеризация продолжалась в течение 30-40 минут. После полимеризации воду удаляли и заливали раствор, формирующий концентрирующий гель. Для приготовления такого раствора брали 660 мкл раствора 1, 100 мкл раствора 4, 2,5 мл раствора 3, 4 мкл раствора 6, 70 мкл раствора 5 и 6 мл дистиллированной воды. Вставляли формирователь лунок и наслаивали 0,3 мл дистиллированной воды. Полимеризация продолжалась в течение 20 минут, после чего пластины ПААГ могли храниться при =4°С в течение двух суток.
Подготовка проб Для приготовления анализируемого образца для ЭФ брали 1 мг лиофилизированных мембран эритроцитов и растворяли в 40 мкл уравновешивающего буфера, в состав которого входили:
(на 10 мл уравновешивающего буфера)
1. 3 г мочевины;
2. 0,2 г ДДС;
3. 1,25 мл раствора 3;
4. 0,5 мл меркаптоэтанола;
5. 5 мкл красителя бромфенолового синего.
Уравновешивающий буфер хранили при температуре -20°С в течение месяца.
Подготовленные таким образом анализируемые образцы стояли в течение одного часа при комнатной температуре, после чего их вносили объемом 15 мкл в сформированные в концентрирующем геле лунки.
Электрофорез проводили при силе тока 35 мА, пока напряжение не возрастало до 300 В, затем стабилизировали источник питания по данному напряжению и проводили ЭФ этом режиме, пока лидирующий краситель не доходил 1 см до края пластины.
После ЭФ фореграммы окрашивали в течение одного часа красителем Кумасси G - 255 по модифицированной методике Fairbanks в растворе, содержащем 10% уксусной кислоты, 25% изопропанола, 0,05% кумасси голубого. После этого несвязавшуюся краску отмывали в течение 12 часов 10%-ной уксусной кислотой до полного исчезновения фонового окрашивания.
Отмытые фореграммы затем дегидратировали в течение 30 минут в растворе, содержащем 280 мл изопропанола, 25 мл глицерина и 195 мл дистиллированной воды. Далее пластины ПААГ плотно фиксировали между двумя слоями целлюлозной бумаги и в натянутом виде высушивали при комнатной температуре.
На электрофореграммах идентифицировали 17 белковых фракций.
Денситометрирование. Денситометрирование электрофореграмм проводили на лазерном денситометре «Ultrascan XL». Молекулярную массу белков определяли с помощью маркерных белков с известной молекулярной массой: бычий сывороточный альбумин (Mr=68 kD), овальбумин (Mr=43 kD), химотрипсиноген (Мr=25 kD), миоглобин (Мr=17,5 kD) и цитохром (Мr=12,4 kD).
Определение концентрации белка. Содержание белковых фракций в исследуемом образце определяли по известной массе маркерного белка бычьего сывороточного альбумина, через полученные при деситометрировании площади альбумина и каждой белковой фракции в отдельности по формуле:
m(x)=S(x)´4.5/S(a),
где m(x) – масса белковой фракции,
S(x) – площадь этой фракции под пиком на денситограмме
4.5 – масса маркерного белка альбумина в мкг,
S(a) – площадь маркерного белка альбумина под пиком на денситограмме.
Дальнейший пересчет количественного содержания белковых фракций проводили на 1 миллиграмм общего белка.
Методы статистической обработки
Статистическая обработка материала проведена на ПВМ IBM PC/AT (486) с использованием программы "Gen 1", составленной д.б.н Трубниковым В.И. и пакета прикладных программ "STATGRAPHICS v3.0".
При описании количественных признаков использовались параметры нормального распределения: среднее значение, стандартная ошибка среднего значения, несмещенная дисперсия. Для проверки статистических гипотез использовались параметрические критерии Стьюдента и Фишера. Уровень значимости принимали равный 0,05.
Кластерный анализ. При проведении кластерного анализа в качестве объектов выступали индивиды и изучаемые признаки, а мерой сходства служили коэффициенты корреляции без учета знака. Результаты кластерного анализа позволили определить соответственно некоррелированные группы изучаемых параметров, детерминирующих фенотипическую изменчивость признаков. На каждом шаге кластеризации выбирался наибольший по значению элемент матрицы, стоящий на пересечении i-й строки и j-го столбца объединения i-го и j-го признаков в кластер, рассматриваемый как новый признак. Для выделения кластера пересчитывались значения коэффициентов корреляции в матрице с тем, чтобы на следующем шаге кластеризации поиск максимального коэффициента корреляции проводился с учетом предыдущих результатов. Приведенный алгоритм кластерного анализа служил лишь для подразделения корреляционной матрицы на отдельные подсистемы без проверки статистической значимости уровней объединения кластеров. Проверка гипотезы о некоррелированности выделенных подсистем осуществлялась с использованием специальных критериев.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Количественное содержание гемоглобина и основных белков мембран эритроцитов человека.
В ходе данной работы нами было проведено изучение количественного содержания основных белков эритроцитарных мембран и мембрансвязанного гемоглобина. Полученные результаты представлены в таблице 1.
В зависимости от электрофоретической подвижности белки были разделены на 15 фракций, 16-ю составил гемоглобин. При электрофорезе белковые фракции расположились по мере уменьшения молекулярных масс белков. Из таблицы 1 видно, что наиболее представительными белками в мембранах эритроцитов человека являются анионтранспортный белок полосы 3, a- и b-спектрины и актин. Второе место по количественному содержанию заняли белки полосы 4.5 (транспортер глюкозы и нуклеозидов), белки полосы 7 (основным белком этой полосы является тропомиозин) и белок полосы 4.2 (паллидин).
Менее представительными оказались анкирины 2.1, 2.2, и 2.3, белок полосы 4.1, глицеральдегид-3-фосфатдегидрогеназа и глутатион-S-трансфераза. Наименьшим содержанием отличался белок полосы 4.9 и мембрансвязанный гемоглобин. Количественное содержание гемоглобина составило 17,40±0,74 мкг на 1 мг общего белка мембран. Кроме того, гемоглобину соответствовало и наименьшее значение дисперсии (d2= 66,91).
Проведенное исследование количественного содержания основных белков мембран эритроцитов позволило оценить их представительность. Полученные нами показатели согласуются с литературными данными. [4, 5]
Взаимное варьирование количественной представительности отдельных белков эритроцитов человека.
С целью установления особенностей взаимного варьирования содержания белковых фракций в анализируемых образцах нами был проведен многомерный количественного содержания белков эритроцитарных мембран человека. Была построена матрица фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов. Данная матрица представлена в таблице 2. Из нее видно, что полученные коэффициенты корреляции имели как положительную, так и отрицательную направленность.
Для установления приоритетности во взаимосвязях вариабельности количественного содержания гемоглобина и основных мембранных белков эритроцитов нами был проведен кластерный анализ. Полученные результаты представлены на рисунке 6.
Кластерный анализ корреляционной матрицы позволил выделить 4 группы взаимнокоррелирующих белков по их количественному содержанию. Первую группу составили a- и b-спектрины, белки полосы 4.1, 4.2 (r=0,255). В состав второй группы вошли анкирины 2.1, 2.2 и 2.3 (r=0,278). Третью группу образовали гемоглобин, тропомиозин, глютатион-S-трансфераза и белок полосы 4.5.1 (r=0,316). Четвертую группу составили актин, белки полосы 4.5, глицеральдегид-3-фосфатдегидрогеназа и анионтранспортный белок полосы 3 (r=0,209). Исключение составила фракция 4.9, вариабельность количественного содержания которой носила независимый характер.
Низкий уровень объединения наблюдался между количественным содержанием анкирином 2.3 и анкирином 2.1 и 2.2 (r=0,278), актином и белком полосы 4.5 (r=0,327).
Рисунок 6
Дендрограмма фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов человека
N = 124 R (5%) = 0,176
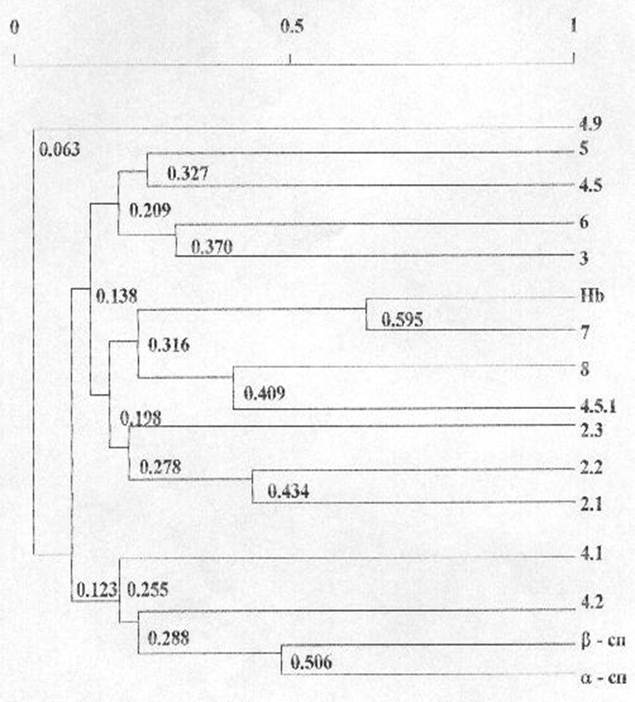
Группу кластеров со средним уровнем
объединения составили анкирины 2.1 и 2.2 (r=0,434),
глутатион-S-трансфераза и белок полосы 4.5.1 (r=0,409),
глицеральдегид-3-фосфатдегидрогеназа и белок полосы 3 (r=0,370).
Высокий уровень объединения имел место между количественным содержанием a- и b-спектринов (r=0,506)
Самый высокий уровень объединения (r=0,595) соответствовал количественному содержанию гемоглобина и белков полосы 7, основным составляющим белком которой является тропомиозин.
Обсуждение
На основе полученных данных установлено, что наиболее представительными белками в мембранах эритроцитов человека являются анионтранспортный белок полосы 3, a- и b-спектрины, а также актин. Наименьшее количественное содержание соответствует мембрансвязанному гемоглобину. Несмотря на то, что он содержится в мембране эритроцитов человека в меньшем количестве, гемоглобин играет важную роль как в образовании и поддержании стабильности цитоскелета, так и в механизмах ферментативного катализа и внутриклеточной трансформации энергии.
Полученные данные позволили предположить, что в эритроцитарных мембранах рассматриваемые белки во взаимном варьировании их количественного содержания образуют 4 группы взаимнокоррелирующих систем. Причем каждая из этих групп по отношению к остальным характеризуется относительной независимостью.
Согласно результатам нашего исследования количественное содержание гемоглобина наиболее тесно связано с содержанием тропомиозина. О причинах этого пока судить трудно вследствие недостаточного количества данных, касающихся этого вопроса - в доступной нам литературе он не получил должного освещения. Но мы надеемся, что полученные данные послужат основой для дальнейшей детализации в изучении связи гемоглобина со структурными белками.
Таким образом, полученные нами данные свидетельствуют о сложной структурной и функциональной взаимосвязи белков в мембранах эритроцитов.
заключениеЦитоплазматические мембраны эритоцитов человека играют ключевую роль в обеспечении и регуляции физиологической активности этих клеток. Специфические функции мембран обеспечивает сложная структурная организация, главным компонентом которой являются белки.
Современные биохимические и биофизические методы позволили выделить практически все основные мембранные белки эритроцитов, изучить их биохимическую структуру и основные аспекты функционирования. Вместе с тем в научной литературе не получил должного освещения вопрос о структуре мембрансвязанного гемоглобина, о его связи со структурными белками. Нами была проведена оценка количественного содержания гемоглобина и основных белков мембран эритроцитов человека, так как нормальное функционирование мембраны определяется не только присутствием белковых компонент, но и их количественным содержанием.
Кроме того был предпринят анализ взаимоварьирования количественного содержания гемоглобина и структурных белков. В ходе исследования нами был установлен факт взаимозависимости количественного содержания гемоглобина и тропомиозина. Результаты данного исследования могут служить основой для дальнейшей детализации в изучении связи гемоглобина со структурными белками. Нами планируется провести ряд исследований с целью изучения количественного содержания гемоглобина и его взаимосвязи со структурными белками мембран эритроцитов не только в норме, но и при различных патологических состояниях. С тем, чтобы прогнозировать наряду с уровнем данных нарушений их связь между собой и влияние на них изменений окружающей среды.
выводы
1. Количественное содержание гемоглобина в мембранах эритроцитов составляет 17,40±0,74 мкг на 1 мг общего белка мембран и является наименьшим, по сравнению с количественным содержанием остальных мембранных белков.
2. Вариабельность количественного содержания гемоглобина характеризуется достаточно высокой сопряженностью с количе37ственным содержанием белка полосы 7 – тропомиозина.
Литература
1. Балашов В.И., Резаев А.А., Ярыга В.В. Содержание гемоглобина и его дериватов в крови детей, проживающих в населенных пунктах санитарно-защитной зоны астраханского газового комплекса// Педиатрия. – 1995. - №2. – С.75-77.
2. Блюменфельд Л.А. Гемоглобин// Соросовский образовательный журнал. – 1998. - №4. – С.33-38.
3. Гааль Э., Медьеши Г., Верецки Л. Электрофорез в разделении биохимических макромолекул. – М. – 1982. – 446с.
4. Гончаренко М.С., Андрух Г.А., Рязанцев В.В. Белковый спектр эритроцитарных мембран в норме и при псориазе// Вестник дерматологии и венерологии. – 1989. - №3. – С.4-7.
5. Гончарова Е.И., Пинаев Г.П. Белки цитоскелета эритроцитов// Цитология. – 1988. – т.30, №1. – С.5-18.
6. Громов П.С., Захаров С.Ф., Шишин С.С., Ильинский Р.В. Двумерная карта мембранных белков эритроцитов человека// Биохимия. – 1988. – т.53, вып.8. – С.1316-1326.
7. Громов П.С., Шандала А.М., Ковалев Л.И., Шишкин С.С. Изучение белков мембран эритроцитов человека методом двумерного электрофореза// Бюллетень экспериментальной биологии и медицины. – 1986. - №7. – С.28-30.
8. Казеннов А.М., Маслова М.Н. Влияние мембранного скелета безъядерных эритроцитов на свойства транспортных АТФаз// Цитология. – 1991. – т.33, №11. – С.32-41.
9. Казеннов А.М., Маслова М.Н. Структурно-биохимические свойства мембраны безъядерных эритроцитов// Физиологический журнал СССР им. И.М.Сеченова. – 1987. – т.73, №12. – С.1587-1594.
10. Казеннов А.М., Маслова М.Н., Шагабодов А.Д. Роль белков мембранного скелета безъядерных эритроцитов в функционировании мембранных ферментов// Докл. АН СССР – 1990. – т.312. - №1. – С.223-226.
11. Лакин Г.Ф. Биометрия: Учебное пособие для биол. спец. Вузов – 4-е изд., перераб. и доп. – М.: Высш.шк., 1990. – 352с.
12. Остерман Л.А. Методы исследования белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование. – М.: Наука, 1981. – 288с.
13. Петренко Ю.М., Владимиров Ю.А. Роль поверхностных зарядов в поддержании осмотической резистентности эритроцитов// Гематология и трансфузиология. – 1987. - №10. – С.15-18.
14. Солодилова М.А. Роль генетических и средовых факторов в детерминации количественного содержания основных белков мембран эритроцитов человека/ Дис. на соискание ученой степени к.б.н. – М., 1999. – 160с.
15. Шандала А.М., Захаров С.Ф., Громов П.С., Шишкин С.С. Белковый состав мембран эритроцитов человека, фракционных в ступенчатом градиенте декстрана// Гематология и трансфузиология. – 1987. - №10. – С.28-31.


