 Реферат: Характеристика белков
Реферат: Характеристика белков
Складчатые структуры белка.
Одним из распространенных примеров складчатой периодической структуры белка являются так называемые b-складки, состоящие из двух фрагментов, каждый из которых представлен полипептидом.
b-складки также стабилизируются водородными связями между атомом водорода аминной группы одного фрагмента и атомом кислорода карбоксильной группы другого фрагмента. При этом фрагменты могут иметь как параллельную, так и антипараллельную ориентацию относительно друг друга.
Для того чтобы два участка полипептидной цепи располагались в ориентации, благоприятствующей образованию b-складок, между ними должен существовать участок, имеющий структуру, резко отличающийся от периодической.
Возникновение a- и b-структур в белковой молекуле является следствием того, что аминокислоты и в составе полипептидных цепей сохраняют присущую им способность к образованию водородных связей. Таким образом, крайне важное свойство аминокислот — соединяться друг с другом водородными связями в процессе образования кристаллических препаратов — реализуется в виде a-спиральной конформации или b-структуры в белковой молекуле. Следовательно, возникновение указанных структур допустимо рассматривать как процесс кристаллизации участков полипептидной цепи в пределах одной и той же белковой молекулы.
Третичная структура
 Сведения о чередовании аминокислотных
остатков в полипептидной цепи (первичная структура) и наличие в белковой
молекуле спирализованных, слоистых и неупорядоченных ее фрагментов (вторичная
структура) еще не дают полного представления ни об объеме, ни о форме, ни тем
более о взаимном расположении участков полипептидной цепи по отношению друг к
другу. Эти особенности строения белка выясняют при изучении его третичной
структуры, под которой понимают — общее расположение в пространстве
составляющих молекул одной или нескольких полипептидных цепей, соединенных ковалентными
связями. То есть третичная конфигурация —
реальная трехмерная конфигурация, которую принимает в пространстве закрученная
спираль, которая в свою очередь свернута спиралью. У такой структуры в пространстве
имеются выступы и впадины с обращенными наружу функциональными группами.
Сведения о чередовании аминокислотных
остатков в полипептидной цепи (первичная структура) и наличие в белковой
молекуле спирализованных, слоистых и неупорядоченных ее фрагментов (вторичная
структура) еще не дают полного представления ни об объеме, ни о форме, ни тем
более о взаимном расположении участков полипептидной цепи по отношению друг к
другу. Эти особенности строения белка выясняют при изучении его третичной
структуры, под которой понимают — общее расположение в пространстве
составляющих молекул одной или нескольких полипептидных цепей, соединенных ковалентными
связями. То есть третичная конфигурация —
реальная трехмерная конфигурация, которую принимает в пространстве закрученная
спираль, которая в свою очередь свернута спиралью. У такой структуры в пространстве
имеются выступы и впадины с обращенными наружу функциональными группами.
Полное представление о третичной структуре дают координаты всех атомов белка. Благодаря огромным успехом рентгеноструктурного анализа такие данные, за исключением координат атомов водорода получены для значительного числа белков. Это огромные массивы информации, хранящиеся в специальных банках данных на машиночитаемых носителях, и их обработка немыслима без применения быстродействующих компьютеров. Полученные на компьютерах координаты атомов дают полную информацию о геометрии полипептидной цепи, что позволяет выявить спиральную структуру, b-складки или нерегулярные фрагменты.
Третичная структура формируется в результате нековалентных взаимодействий (электростатические, ионные, силы Ван-дер-Ваальса и др.) боковых радикалов, обрамляющих a-спирали и b-складки, и непериодических фрагментов полипептидной цепи. Среди связей, удерживающих третичную структуру, следует отметить:
а) дисульфидный мостик (–S–S–) между двумя остатками цистеина;
б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой);
в) солевой мостик (между карбоксильной группой и аминогруппой);
г) водородные связи между группами -СО - и -NH-;
Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность.
Первые пространственные модели молекул белка — миоглобина и гемоглобина — построили в конце 50-х гг. XX в. английские биохимики Джон Ко-удери Кендрю (родился в 1917 г.) и Макс Фердинанд Перуц (родился в 1914 г.). При этом они использовали данные экспериментов с рентгеновскими лучами. За исследования в области строения белков Кендрю и Перуц в 1962 г. были удостоены Нобелевской премии. А в конце столетия была определена третичная структура уже нескольких тысяч белков.
Четвертичная структура
У большинства белков пространственная организация заканчивается третичной структурой, но для некоторых белков с молекулярной массой больше 50-100 тысяч, построенных из несколько полипептидных цепей характерна четвертичная.
Сущность такой структуры в объединении несколько полимерных цепей были в единый комплекс. Такой комплекс также рассматривается как белок, состоящий из нескольких субъединиц. Белки, состоящие из нескольких субъединиц, широко распространены в природе (гемоглобин, вирус табачной мозаики, фосфорилаза, РНК-полимераза). Субъединицы принято обозначать греческими буквами (так у гемоглобина имеется по две a и b субъединицы). Наличие нескольких субъединиц важно в функциональном отношении — оно увеличивает степень насыщения кислородом.
 Четвертичная
структура ( клубок белков)
Четвертичная
структура ( клубок белков)
Четвертичная структура стабилизируется в основном силами слабых воздействий:
а) водородная; б) гидрофобная; в) ионные; г) ковалентные (дисульфидные, пептидные).
Денатурация белков
Денатурация белка — разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и сопровождаемое изменением растворимости, вязкости, химической активности, характера рассеивания рентгеновских лучей, снижением или полной потерей биологической функции.
Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию.
Обратным процессом является ренатурация, то есть восстановление физико-химических и биологических свойств белка. Иногда для этого достаточно удалить денатурирующий объект. Ренатурация невозможна если затронута первичная структура.
Химические и физические свойства
Несмотря на внешнее несходство, различные представители белков обладают некоторыми общими свойствами.
Так, поскольку все белки являются коллоидными частицами (размер молекул лежит в пределах 1 мкм до 1 нм), в воде они образуют коллоидные растворы. Эти растворы характеризуются высокой вязкостью, способностью рассеивать лучи видимого света, не проходят сквозь полупроницаемые мембраны.
Вязкость раствора зависит от молекулярной массы и концентрации растворенного вещества. Чем выше молекулярная масса, тем раствор более вязкий. Белки как высокомолекулярные соединения образуют вязкие растворы. Например, раствор яичного белка в воде.
Коллоидные частицы не проходят через полупроницаемые мембраны (целлофан, коллоидную пленку), так как их поры меньше коллоидных частиц. Непроницаемыми для белка являются все биологические мембраны. Это свойство белковых растворов широко используется в медицине и химии для очистки белковых препаратов от посторонних примесей. Такой процесс разделения называется диализом. Явление диализа лежит в основе действия аппарата “искусственная почка”, который широко используется в медицине для лечения острой почечной недостаточности.
Белки способны к набуханию, характеризуются оптической активностью и подвижностью в электрическом поле, некоторые растворимы в воде. Белки имеют изоэлектрическую точку.
Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, то есть выступать в роли амфотерных электролитов. Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот. Например, кислотные свойства белку придают карбоксильные группы аспарагиновой и глутаминовой аминокислот, а щелочные — радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства и наоборот.
Эти же группировки имеют и электрические заряды, формирующие общий заряд белковой молекулы. В белках, где преобладают аспарагиновая и глутаминовая аминокислоты, заряд белка будет отрицательным, избыток основных аминокислот придает положительный заряд белковой молекуле. Вследствие этого в электрическом поле белки будут передвигаться к катоду или аноду в зависимости от величины их общего заряда. Так, в щелочной среде (рН 7–14) белок отдает протон и заряжается отрицательно (движение к аноду), тогда как в кислой среде (рН 1–7)
подавляется диссоциация кислотных групп и белок становится катионом (движение к катоду):
![]()
![]()
![]() NH3+ кислая ср. NH3+
щелочная ср. NH2
NH3+ кислая ср. NH3+
щелочная ср. NH2
![]()
![]()
![]()
![]()
![]() R
R R
R
R R
COOH COO – COO –
Катион Амфион Анион
Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией водородных ионов и выражается величиной рН. Однако при определенных значениях рН число положительных и отрицательных зарядов уравнивается и молекула становится электронейтральной, то есть она не будет перемещаться в электрическом поле. Такое значение рН среды определяется как изоэлектрическая точка белков. При этом белок находится в наименее устойчивом состоянии и при незначительных изменениях рН в кислую или щелочную сторону легко выпадает в осадок. Для большинства природных белков изоэлектрическая точка находится в слабокислой среде (рН 4,8–5,4), что свидетельствует о преобладании в их составе дикарбоновых аминокислот.
Свойство амфотерности лежит в основе буферных свойств белков и их участии в регуляции рН крови. Величина рН крови человека отличается постоянством и находится в пределах 7,36–7,4 , несмотря на различные вещества кислого или основного характера, регулярно поступающие с пищей или образующиеся в обменных процессах, следовательно, существуют специальные механизмы регуляции кислотно-щелочного равновесия внутренней среды организма.
Белки активно вступают в химические реакции. Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Важно, что такие взаимодействия происходят и внутри белковой молекулы, в результате чего образуется пептидная, водородная, дисульфидная и другие виды связей. К радикалам аминокислот, а, следовательно, и белков, могут присоединяться различные соединения и ионы.
Белки обладают большим сродством к воде, то есть они гидрофильны. Это значит, что молекулы белка, как заряженные частицы, притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку. Эта оболочка предохраняет молекулы белка от склеивания и выпадения в осадок. Величина гидратной оболочки зависит от структуры белка. Например, альбумины более легко связываются с молекулами воды и имеют относительно большую водную оболочку, тогда как глобулины, фибриноген присоединяют воду хуже, и гидратная оболочка и них меньше. Таким образом, устойчивость водного раствора белка определяется двумя факторами: наличием заряда белковой молекулы и находящейся вокруг нее водной оболочки. При удалении этих факторов белок выпадает в осадок. Данный процесс может быть обратимым и необратимым.
Обратимое осаждение белков (высаливание) предполагает выпадение белка в осадок под действием определенных веществ, после удаления которых он вновь возвращается в свое исходное (нативное) состояние. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд. Между величиной водной оболочки белковых молекул и концентрацией солей существует прямая зависимость: чем меньше гидратная оболочка, тем меньше требуется солей. Так, глобулины, имеющие крупные и тяжелые молекулы и небольшую водную оболочку, выпадают в осадок при неполном насыщении раствора солями, а альбумины как более мелкие молекулы, окруженные большой водной оболочкой — при полном насыщении.
Необратимое осаждение связано с глубокими внутримолекулярными изменениями структуры белка, что приводит в потере ими нативных свойств — денатурации , которая влечет потерю растворимости, биологической активности и т.д. Необратимое осаждение можно вызвать кипячением, действием концентрированными растворами некоторых из минеральных и органических кислот, солями тяжелых металлов . Примером естественно вызванной денатурации служит расщепление белков в желудке, где имеется сильнокислая среда (рН 0,5–1,5), под действием протеолитических ферментов. Денатурация белков положена в основу лечения отравления тяжелыми металлами, когда больному вводят per os (“через рот”) молоко или сырые яйца с тем, чтобы металлы адсорбировались на поверхности денатурирующего белка и не действовали на белки слизистой оболочки желудка и кишечника, а также не всасывались в кровь.
Гидролиз белка достигается при помощи кипячения белка с сильными минеральными кислотами (кислотный гидролиз) или основаниями (щелочной гидролиз). Схема следующая:
О H О Н О О
![]()
![]() NH2 — СН—С—N—СH—С—N—СН—С—
·· + nH2O ·· + NH2—СН—С—ОН +
NH2 — СН—С—N—СH—С—N—СН—С—
·· + nH2O ·· + NH2—СН—С—ОН +
R1 R2 R3 R1
O O
+ NH2—СН—С—ОН + NH2—СН—С—ОН + ··
R2 R3
Химический синтез
Химический синтез белков имеет большое практическое и теоретическое значение. В практическом отношении важны белковые гормоны — инсулин и вазопрессин, в настоящее время получаемые синтетическим путем. Умение производить искусственным путем необходимые белки откроет огромные ресурсы для использования в медицине, технике и т.д.
Традиционные методы синтеза регулярных полимеров позволяют получить сополимеры, состоящие из двух (или более) сходных типов мономеров со статистическим распределением их по цепи, в том числе белков. В частности, возможно получение гомополимеров или статистических сополимеров, состоящих из аминокислотных остатков, связанных пептидными связями (полиаминокислот).
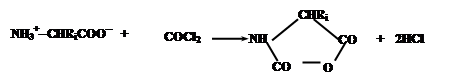
В качестве примера можно привести процесс получения полиаминокислот, основанный на конденсации N-карбоксиангидридов аминокислот, образуемых из соответствующих аминокислот обработкой фосгеном:
Эти соединения содержат электрофильную ангидридную группу, которая может атаковать алифатическую аминогруппу аминокислоты, используемой в качестве затравки, с выделением СО2 и одновременном освобождением новой аминогруппы из атакующей молекулы N-карбоксиангидрида, таким образом, открывая возможность поликонденсации:
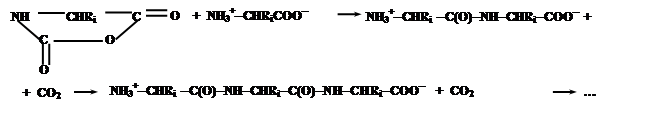
Нетрудно заметить, что каждая стадия поликонденсации (с учетом реакции образования N-карбоксиангидридов аминокислот) сопровождается превращением молекулы COCl2 в CO2 и 2HCl, что термодинамически выгодно и является источником свободной энергии для образования пептидной связи.
При синтезе нерегулярных полипептидов базируются также на активации карбоксильных групп. Большинство из них базируется на использовании N,N-дициклогексилкарбодиимида (ДЦК). Он способен в присутствии RCOO- и амина NH2R’ осуществить активацию карбоксильных групп:
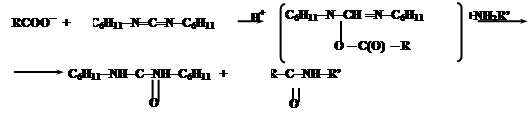
Промежуточным соединением является O-ацил-N,N’-дициклогексилмочевину (ДЦМ):
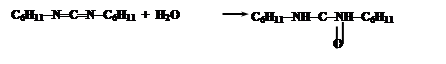
Значение белков
Функции белков чрезвычайно многообразны. Каждый данный белок как вещество с определенным химическим строением выполняет одну узкоспециализированную функцию и лишь в нескольких отдельных случаях — несколько взаимосвязанных. Например, гормон мозгового слоя надпочечников адреналин, поступая в кровь, повышает потребление кислорода и артериальное давление, содержание сахара в крови, стимулирует обмен веществ, а также является медиатором нервной системы у холоднокровных животных.



![]() Белки
Белки
 |
|||
 |
|||
Схема практического значения белков
.
Каталитическая (ферментативная) функция
Многочисленные биохимические реакции в живых организмах протекают в мягких условиях при температурах, близких к 40°С, и значениях рН близких к нейтральным. В этих условиях скорости протекания большинства реакций ничтожно малы, поэтому для их приемлемого осуществления необходимы специальные биологические катализаторы — ферменты. Даже такая простая реакция, как дегидратация угольной кислоты:
![]()
![]() CO2 + H2O HCO3-+
H+
CO2 + H2O HCO3-+
H+
катализируется ферментом карбоангидразой. Вообще все реакции, за исключением реакции фотолиза воды 2H2O®4H+ + 4e- + O2, в живых организмах катализируются ферментами (реакции синтеза, осуществляются при помощи ферментов синтетаз, реакции гидролиза — при помощи гидролаз, окисление — при помощи оксидаз, восстановление с присоединением — при помощи гидрогеназ и т.д.). Как правило, ферменты — это либо белки, либо комплексы белков с каким-либо кофактором — ионом металла или специальной органической молекулой. Ферменты обладают высокой, иногда уникальной, избирательностью действия. Например, ферменты, катализирующие присоединение a-аминокислот к соответствующим т-РНК в процессе биосинтеза белка, катализируют присоединение только L-аминокислот и не катализируют присоединение D-аминокислот.
Транспортная функция белков
Внутрь клетки должны поступать многочисленные вещества, обеспечивающие ее строительным материалом и энергией. В то же время все биологические мембраны построены по единому принципу — двойной слой липидов, в который погружены различные белки, причем гидрофильные участки макромолекул сосредоточены на поверхности мембран, а гидрофобные “хвосты” — в толще мембраны. Данная структура непроницаема для таких важных компонентов, как сахара, аминокислоты, ионы щелочных металлов. Их проникновение внутрь клетки осуществляется с помощью специальных транспортных белков, вмонтированных в мембрану клеток. Например, у бактерий имеется специальный белок, обеспечивающий перенос через наружную мембрану молочного сахара — лактозы. Лактоза по международной номенклатуре обозначается b-галаткозид, поэтому транспортный белок называют b-галактозидпермеазой.
Важным примером транспорта веществ через биологические мембраны против градиента концентрации является К/ Na-ый насос. В ходе его работы происходит перенос трех положительных ионов Na+ из клетки на каждые два положительных иона K+ в клетку. Эта работа сопровождается накоплением электрической разности потенциалов на мембране клетки. При этом расщепляется АТФ, давая энергию. Молекулярная основа натрий-калиевого насоса была открыта недавно, это оказался фермент, расщепляющий АТФ — калий-натрийзависимая АТФ-аза.
У многоклеточных организмов существует система транспорта веществ от одних органов к другим. В первую очередь это гемоглобин. Кроме того, в плазме крови постоянно находится транспортный белок — сывороточный альбумин. Этот белок обладает уникальной способностью образовывать прочный комплексы с жирными кислотами, образующимися при переваривании жиров, с некоторыми гидрофобными аминокислотами со стероидными гормонами, а также со многими лекарственными препаратами, такими, как аспирин, сульфаниламиды, некоторые пенициллины.
Рецепторная функция
Большое значение, в особенности для функционирования многоклеточных организмов, имеют белки-рецепторы, вмонтированные в плазматическую мембрану клеток и служащие для восприятия и преобразования различных сигналов, поступающих в клетку, как от окружающей среды, так и от других клеток. В качестве наиболее исследованных можно привести рецепторы ацетилхолина, находящиеся на мембране клеток в ряде межнейронных контактов, в том числе в коре головного мозга, и у нервно-мышечных соединений. Эти белки специфично взаимодействуют с ацетилхолином CH3C(O) – OCH2CH2N+(CH3)3 и отвечает на это передачей сигнала внутрь клетки. После получения и преобразования сигнала нейромедиатор должен быть удален, чтобы клетка подготовилась к восприятию следующего сигнала. Для этого служит специальный фермент — ацетилхолинэстераза, катализирующая гидролиз ацетилхолина до ацетата и холина.
Многие гормоны не проникают внутрь клеток-мишеней, а связываются со специфическими рецепторами на поверхности этих клеток. Такое связывание является сигналом, запускающим в клетке физиологические процессы.
Защитная функция
Иммунная система обладает способностью отвечать на появление чужеродных частиц выработкой огромного числа лимфоцитов, способных специфически повреждать именно эти частицы, которыми могут быть чужеродные клетки, например патогенные бактерии, раковые клетки, надмолекулярные частицы, такие как вирусы, макромолекулы, включая чужеродные белки. Одна из групп лимфоцитов — В-лимфоциты, вырабатывает особые белки, выделяемые в кровеносную систему, которые узнают чужеродные частицы, образуя при этом высокоспецифичный комплекс на этой стадии уничтожения. Эти белки называются иммуноглобулины. Чужеродные вещества, вызывающие иммунный ответ называют антигенами, а соответствующие к ним иммуноглобулины — антителами.
Антитела построены из четырех полипептидных цепей, связанных между собой дисульфидными мостиками.
Структурная функции
Наряду с белками, выполняющими тонкие высокоспециализированные функции, существуют белки, имеющие в основном структурное значение. Они обеспечивают механическую прочность и другие механические свойства отдельных тканей живых организмов. В первую очередь это коллаген — основной белковый компонент внеклеточного матрикса соединительной ткани.
В эластичных тканях — коже, стенках кровеносных сосудов, легких - помимо коллагена внеклеточный матрикс содержит белок эластин, способный довольно в широких пределах растягиваться и возвращаться в исходное состояние.
Еще один пример структурного белка — фиброин шелка, выделяемый гусеницами шелкопряда в период формирования куколки и являющийся основным компонентом шелковых нитей.
Двигательные белки
Мышечное сокращение является процессом, в ходе которого происходит превращение химической энергии, запасенной в виде макроэргических пирофосфатных связей в молекулах АТФ, в механическую работу. Непосредственными участниками процесса сокращения являются два белка — актин и миозин.
Антибиотики
Большую и чрезвычайно важную в практическом отношении группу природных органических соединений составляют антибиотики — вещества микробного происхождения, выделяемые специальными видами микроорганизмов и подавляющие рост других, конкурирующих микроорганизмов. Открытие и применение антибиотиков произвело в 40-ые гг. революцию в лечении инфекционных заболеваний, вызываемых бактериями. Следует отметить, что на вирусы в большинстве случаев антибиотики не действуют и применение их в качестве противовирусных препаратов неэффективно.
Токсины
Ряд живых организмов в качестве защиты от потенциальных врагов вырабатывают сильно ядовитые вещества — токсины. Многие из них являются белками, однако, встречаются среди них и сложные низкомолекулярные органические молекулы. В качестве примера такого вещества можно привести ядовитое начало бледной поганки — a-аманитин.
Вывод:
В данной работе при помощи различных схем и таблиц были рассмотрены химические и физические свойства белков, классификация белков, состав и строение белков, были рассмотрены разнообразные функции белков, а также их значение.
Доказано, что белки - обязательная составная часть всех живых клеток, играют исключительно важную роль в живой природе, являются главным, наиболее ценным и незаменимым компонентом питания. Это связанно с той огромной ролью, которую они играют в процессах развития и жизни человека. Белки являются основой структурных элементов и тканей, поддерживают обмен веществ и энергии, участвуют в процессах роста и размножения, обеспечивают механизмы движений, развитие иммунных реакций, необходимы для функционирования всех органов и систем организма.
"Жизнь - это форма существования белка"
 Список использованной литературы:
Список использованной литературы:
· «ХИМИЯ—справочник для абитуриентов и студентов». Издательство acT-Фолио, Москва, 2000 год.
· Большая медицинская энциклопедия.
· «Энциклопедия для детей. Химия». Аванта+, Москва, 2000 год.
· Албертс Б., Брей Д., и др. Молекулярная биология клетки Москва, 1994.
· Биотехнология. Производство белковых веществ. В.А. Быков, М.Н. Манаков . Москва «Высшая школа» 1987г.
· Артеменко А.И. Органическая химия: учеб. для строит. спец. вузов. —М.: Высшая школа, 2000.
· Березин Б.Д., Березин Д.Б. Курс современной органической химии. Учебное пособие для вузов. —М.: Высшая школа, 1999.
· Кнорре Д.Г., Мызина С.Д. Биологическая химия. —М.: Высшая школа, 1998.
· Общая органическая химия. Под ред. Д. Бартона, У.Д. Оллиса. Нуклеиновые кислоты, аминокислоты, петиды, белки. —М.: Химия, 1986.
· Филлпович Ю.Б. Основы биохимии: уч. для студ. хим. и биол. спец. пед. инст. М.:Высшая школа, 1985.
· Шамин А.Н. История химии белка. —Москва : «Наука», 1977.
· Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки. Москва: «Мир», 1985.


